 Реферат: Анализ азота и его соединений
Реферат: Анализ азота и его соединений
Реактивы
Боратный буферный раствор), рН = 9,5. К 500 мл 0,025 М раствора тетрабората натрия содержащего 9,5 г/л Na2B4O7 10H2O) приливают 88 мл 0,1 н. раствора NaOH и разбавляют безаммиачной водой до 1 л.
Фосфатный буферный раствор, рН = 7,4. В дистиллированной воде, не содержащей аммиака и аммонийных солей, растворяют 14,3 г безводного KH2PO4 и 68,8 г безводного К2НРО4 и разбавляют такой же водой до 1 л.
Дехлорирующий раствор, 1 мл одного из нижеследующих растворов может восстановить до 1 мг/л остаточного хлора в 500 мл пробы.
Арсенат натрия, 1 г NaAsO2 растворяют в безаммиачной воде и разбавляют до 1 л.
Сульфит натрия, 0,9 г Na2SO3 растворяют в безаммиачной воде н разбавляют до 1 л.
Тиосульфат натрия, 3,5 г Na2S2O3 5H2O растворяют в безаммиачной воде и разбавляют до 1 л.
Поглощающий раствор. Растворяют 40 г Н3ВО3 в безаммиачной воде и разбавляют такой же водой до 1 л. При определении фенолгипохлоритным методом поглощающим раствором служат 40 мл 0,2 н. 1-12504 или НС1.
Ход отгонки. Отгонку следует проводить в комнате, воздух которой не содержит аммиака. В колбу для отгонки вместимостью 800-1000 мл помещают 400 мл анализируемой сточной воды (или меньший объем, разбавленный до 400 мл безаммиачной водой), Если проба содержит «активный хлор», ее предварительно дехлорируют добавлением эквивалентного количества одного из перечисленных выше дехлорирующих реагентов. Нейтрализуют, если надо, пробу до рН = 7 разбавленной кислотой или щелочью, определив необходимое количество титрованием отдельной порции. Затем приливают 25 мл буферного раствора (pH=9.5 или 7,4 в зависимости от предполагаемых загрязнений) или 20 мл раствора едкого натра при анализе фенольных вод. В приемник наливают 50 мл поглощающего раствора. Отгоняют 300 мл жидкости, количественно переносят отгон в мерную колбу вместимостью 500 мл, разбавляют до метки безаммиачной дистиллированной водой и перемешивают.
7.1.2. Титриметрический метод
Реактивы
Бромфеноловый синий. В 3,00 мл 0,05 н. раствора едкого натра растворяют 0,1 г бромфенолового синего и разбавляют до 100 мл дистиллрованной водой.
Метиловый красный. В 7,4 мл 0,05 н. раствора едкого натра растворяют 0,1 г метилового красного и разбавляют до 100 мл дистиллированной водой.
Стандартный раствор серной кислоты, 0,02 н.; 1 мл этой кислоты соответствует 0,28 мг аммонийного азота, 0,36 мг NH+4, 0,34 мг NH3.
Ход анализа. К аликвотной части полученного после перегонки раствора (или ко всему раствору, не разбавляя его в мерной f колбе) прибавляют несколько капель того или другого индикатора и титруют 0,02 н. раствором серной кислоты до изменения окраски индикатора. В качестве раствора-свидетеля используют дистиллированную воду, освобожденную от СО2 кипячением, прибавляют те же количества раствора борной кислоты и индикатора. Проводят холостой опыт со всеми примененными в анализа реактивами.
Расчет. Содержание аммонийных ионов (х) в мг/л находят по формуле
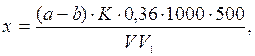 если отбирали аликвотную
часть
если отбирали аликвотную
часть
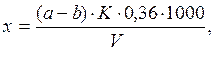 если титровали весь отгон
если титровали весь отгон
где а - объем 0,02 н. серной кислоты, израсходованной на титрование пробы, мл; b - объем той же кислоты, израсходованной в холостом опыте, мл; К - поправочный коэффициент для приведения концентрации серной кислоты к точно 0,02 н.; V - объем сточной воды, взятой для анализа, мл, V1 - объем отобранной аликвотной части; 500 - вместимость мерной колбы, мл; 0,36 - количество NH+4, эквивалентное 1 мл точно 0,02 н. серной кислоты, мг.
7.1.3. Фотометрический фенол-гипохлоритный
метод
При взаимодействии аммиака с гипохлорит-ионами образуется монохлорамин, который далее с фенолятом даст n-аминофенол:
![]()
![]()
Последний, реагируя со второй молекулой фенола, образует сначала 4,4’-дигидрксидифениламин, а затем краситель индофенол:
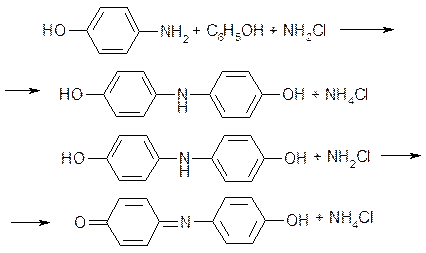
Предполагалось, что добавляемый в раствор нитропруссид натрия служит в этих процессах катализатором, однако наши исследования показали, что он вступает в реакцию с парааминофенолом с образованием продукта, имеющего также синюю окраску. Реакция идет в обоих направлениях, и в результате интенсивность получаемой окраски возрастает и повышается чувствительность метода:
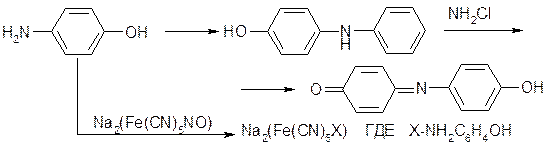
В качестве катализатора и стабилизирующего агента вводят соль марганца.
Мешающие вещества. Определению NH+4 фенолгипохлоритным методом мешают немногие вещества; их значительно меньше, чем при определении с реактивом Несслера. Это дает возможность во многих случаях проводить определение NH+4 без предварительной отгонки аммиака. В частности, было показано, что определение без предварительной отгонки вполне применимо при анализе сточных вод, содержащих наряду с аммиаком ряд органических соединений, в состав которых входит азот (меламин, дицианамид, карбамид, циануровая кислота).
Мешают сильно сероводород и сульфиды. Их можно удалить, подкислив пробу до pH=3 и пропустив воздух до исчезновения запаха сероводорода. Мешают восстановители, реагирующие с гипохлоритом (например, цианиды, роданиды), большая щелочность пробы (выше 500 мг/л), слишком большая кислотность (больше 100 мг-экв/л) и вещества, вызывающие окраску воды или мутность. В таких случаях проводят предварительную отгонку аммиака.
Реактивы
Бидистиллят, не содержащий аммиака. Дважды перегнанную воду пропускают через колонку с катионитом КУ-2. Эту воду используют для приготовления реактивов и разбавления проб.
Фенольный реактив. В 100 мл безаммиачной дистиллированной воды растворяют 5 г бесцветного свежеперегнанного фенола, 25 мл нитропруссида натрия и 0,1 г салициловой кислоты.
Гипохлоритный реактив, 3%-ный раствор. К 50 г хлорной извести (не менее чем 25%-ной по содержанию активного хлора) приливают 85 мл безаммиачной воды и перемешивают. Затем постепенно, при непрерывном перемешивании стеклянной палочкой, в течение 15 мин прибавляют раствор карбоната натрия (35 г безводной соли в 85 мл безаммиачной воды). Полученная масса сначала загустевает, а потом, по мере добавления раствора карбоната натрия, постепенно разжижается. Образующуюся суспензию фильтруют через воронку о стеклянной фильтрующей пластинкой (№ 2), применяя разрежение с помощью водоструйного насоса. Полученный раствор гипохлорита натрия хранят в холодильнике в склянке из темного стекла с притертой пробкой. Перед использованием этот концентрированный раствор разбавляют безаммиачной водой в отношении 1: 1. Можно также применять продажный раствор гипохлорита натрия.
Сульфат марганца. Растворяют 70 мг MgSO4 5Н2 O в 100 мл безам-миачной дистиллированной воды.
Стандартный раствор хлорида аммония. Основной раствор. Растворяют в безаммиачной воде 296,5 мг безводного хлорида аммония NH4Cl , высушенного при 100°, и разбавляют такой же водой до 1000 мл, 1,00 мл полученного раствора содержит 100 мкг NH+4.
Рабочий раствор. Разбавляют безаммиачной дистиллированной водой 5 мл основного стандартного раствора до 100 мл; 1 мл полученного раствора содержит 5 мкг NH+4.
Ход определения. Отбирают 5 мл раствора, полученного после отгонки аммиака, или первоначальной пробы сточной воды, если
она не содержит мешающих
определению веществ. В этом объеме должно быть не более 6 мкг ионов аммония.
Если раствор более концентрированный, отбирают меньший объем и разбавляют до 5
мл безаммиачной водой. Отобранную порцию переносят в пробирку, снабженную
притертой пробкой, прибавляют 1 каплю раствора сульфата марганца, 1 мл
фенольного реактива и перемешивают. Затем приливают 0,5 мл гипохлоритного реактива,
закрывают пробкой и энергично взбалтывают 2 мин. Дают постоять 4 ч для развития
окраски н измеряют оптическую плотность по отношению к холостому раствору в
кювете с толщиной слоя 1 см при ![]() = 625
нм.
= 625
нм.
Содержание NH+4 находят по калибровочному графику, учитывая сделанные разбавления. Для построения калибровочного графика в мерные колбы вместимостью 50 мл наливают 0, 1, 2, 3, 4, 5, 6, 8, 10 и 12 мл рабочего стандартного раствора хлорида аммония и доводят каждый раствор до метки безаммиачной водой, концентрации NH+4 в полученных растворах равны соответственно 0; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6; 0,8; 1,0 и 1,2 мг/л. Эти растворы обрабатывают, как описано выше, и по результатам измерения оптической плотности строят калибровочный график.
7.1.4. Фотометрический метод с реактивом
Несслера
Сущность метода. В щелочном растворе аммиак реагирует с тетранодомеркуратом(II) калия, образуя различные желто-коричневые соединения, выпадающие в осадок или (при малых концентрациях) переходящие в коллоидные растворы. В условиях фотометрического определения реакция в основном проходит по уравнению
![]()
Содержание азота, ртути и иодида в осадке выражается отношением 1:2:3, однако возможно присутствие в осадке и других соединений (OHg2 NH2I и др.). Некоторая неопределенность состава образующегося соединения требует точного соблюдения условий проведения определения как при анализе пробы, так н при построении калибровочного графика.
Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14


