 Реферат: Инфекционно-токсический шок при пневмониях
Реферат: Инфекционно-токсический шок при пневмониях
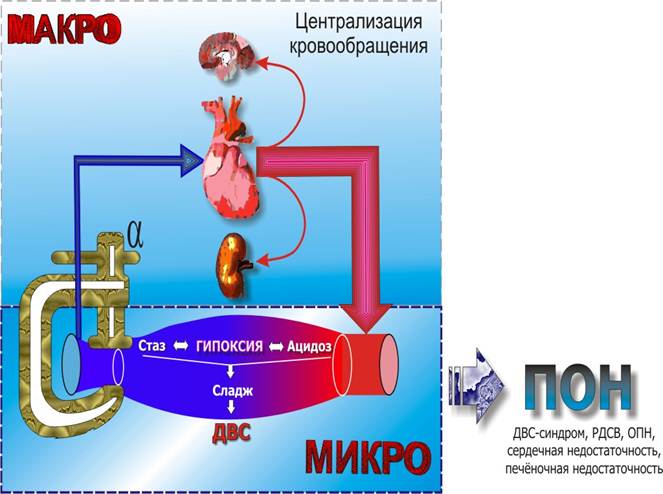
Таким образом, на начальном этапе развития заболевания под воздействием эндотоксинов происходит в первую очередь расширение стенок мелких сосудов (в основном венул), а также значительно повышается проницаемость сосудистой стенки. В результате всего вышеизложенного, несмотря на отсутствие абсолютного дефицита объема, венозный возврат к сердцу уменьшается (относительная гиповолемия). В ответ на это происходит рефлекторное симпатическое сужение вен. Но активное сужение вен эффективно уменьшает венозное кровенаполнение только в том случае, если вены хорошо наполнены и растянуты. Если же трансмуральное давление достаточно низко, чтобы привести вены в полуспавшееся состояние, даже сильные сокращения гладкой мышцы вен оказывают только незначительное влияние на количество крови в них. При такой ситуации сужение вен может даже несколько увеличить местную емкость вен, так как оно делает стенку более жесткой, в результате чего просвет становится большим и приобретает более круглую форму, несмотря на то, что просвет окружности уменьшается. В результате снижения венозного возврата повышается активность симпатической нервной системы, что наряду с непосредственным влиянием эндотоксинов ведет к сокращению пре- и посткапиллярных сфинктеров (стимуляция a-рецепторов). В результате кровоснабжение тканей становится недостаточным, минутный объем сердца в эту фазу большей частью нормальный или даже повышенный (т. е. МОС нормальный или увеличенный, ЧСС увеличивается, общее периферическое сопротивление уменьшается и снижается АД). Артерио-венозная разница по кислороду и обеспечение периферии кислородом понижены.
В дальнейшем по мере дальнейшего развития шока происходит формирование рокового порочного круга. Прекапиллярные артериальные сфинктеры более чувствительны к токсическим влияниям (в том числе ацидозу), поэтому их спазм быстро сменяется парезом. Посткапиллярные (венулярные) сфинктеры более устойчивы к метаболическим нарушениям и длительное время остаются в состоянии тонического напряжения. Таким образом, кровь, притекающая в капиллярное русло депонируется, в связи с чем нарастает тканевая гипоксия, усугубляется метаболический ацидоз, пропотевает плазма с нарастающей компрессией капилляров, что наряду с застоем крови в венозном русле, способствует дальнейшему уменьшению венозного возврата и увеличению относительной гиповолемии.
В результате возникает следующая причинно-следственная связь: стаз в капиллярах - висцеральный застой - уход воды - повышение вязкости крови - агрегация красных и белых кровяных телец, образование красного и белого тромба - истощение факторов свертывания и тромбоцитов вследствие диссеминированного внутрисосудистого свертывания - возникновение изнуряющей коагулопатии с повышенной предрасположенностью к кровотечению.
В пораженных областях аэробные энергетические пути переключаются на анаэробный гликолиз. Переключение окислительного обмена на гликолитический путь значительно увеличивает потребление глюкозы при одновременном уменьшении выхода АТФ. Это снова ведет к снижению уровня глюкозы. Биосинтез белка при шоке ограничен. Это особенно быстро влияет на синтез тех белков, которые имеют короткое время полужизни, например, факторы свертывания. Таким образом, нарушение свертывания крови еще более усиливается. При шоке начинается выход калия из клеток. Метаболический ацидоз возникает в результате увеличенной продукции лактата, а также пирувата, a-кетоглутарата и кетоновых тел. Ацидоз частично компенсируется усиленным дыханием. В результате повышения концентрации Н+ в плазме наблюдается следующее: отрицательное инотропное действие на сердце; снижение чувствительности прекапиллярных сфинктеров в смысле вазомоторных реакций с образованием отеков; повышение выброса катехоламинов; активирование свертывающей системы в качестве одной из причин диссеминированного внутрисосудистого свертывания. Некоторые вещества, образующиеся при шоке (в частности и сами цитокины), обладают отрицательным инотропным действием. Длительное действие этих факторов ведет к расширению сердца и сердечной недостаточности, тем самым, к уменьшению МОК.
Почки. По причине эфферентного сокращения сосудов при шоке уменьшается давление гломерулярной фильтрации, в результате чего развивается олигурия (4-20 мл/ч) или анурия (4 мл/ч). Сужение почечных сосудов сохраняется еще долгое время после нормализации давления крови. Ишемия вызывает прогрессирующий некроз канальцев вследствие гломерулярной, а затем тубулярной недостаточности с образованием цилиндров в дистальных канальцах. Признаком почечной недостаточности является увеличение содержания в крови таких, обычно выделяющихся с мочой соединений, как мочевина и креатинин.
Таким образом, одним из основных патофизиологических механизмов в развитии инфекционно-токсического шока при пневмониях следует считать развитие гиповолемии вследствие секвестрации крови в микроциркуляторном русле и выхода ее в ткани из-за повышения проницаемости капилляров. По образному выражению И. Теодореску-Ексари при ИТШ происходит «кровотечение в собственные сосуды».
Патогенетические стадии
Стадия компенсации
Компенсаторные прессорные реакции, направленные на поддержание АД и восполнение ОЦК. Происходит выброс катехоламинов, вызывающих спазм прекапиллярных сфинктеров. Открываются прямые артериовенозные шунты.
Стадия субкомпенсации
Инициальный спазм прекапилляров сменяется парезом и застоем крови в вено-венулярном отделе микроциркуляторного русла. В эту стадию развивается циркуляторная недостаточность (шок). Снижается венозный возврат к сердцу à снижается сердечный выброс. Включаются компенсаторные реакции – тахикардия, резорбция провизорного фильтрата в почечных канальцах. При уменьшении венозного возврата на 25-30% начинается декомпенсация со снижением АД и нарушением перфузии жизненно важных органов. В этих условиях реализуются механизмы централизации кровообращения.
Нарастает метаболический ацидоз à тахипное. возникают биоплярные изменения КОС – респираторный алкалоз в малом круге и метаболический ацидоз в большом.
Стадия декомпенсации
Характеризуется присоединением ДВС-синдрома à тканевая гипоксия à изменения в шоковых органах.
«Предтечей» ДВС синдрома является изменение реологии крови – сладж феномен.
В нормальных условиях кровь имеет характер стабильной суспензии.
Сохранность суспензионной стабильности крови обеспечивается величиной отрицательного заряда эритроцитов и тромбоцитов (дзета-потенциал – потенциал поверхности скольжения частицы в коллоидном растворе), определяемом соотношением белковых фракций (альбумины/глобулины) и достаточностью кровотока.
Уменьшение отрицательного заряда эритроцитов (увеличение глобулинов или фибриногена, их абсорбция на поверхности эритроцитов) приводит к развитию сладжирования крови.
Сладж (от англ. sludge – густая грязь, тина) – изменение реологии крови, характеризующееся прилипанием друг к другу эритроцитов, лейкоцитов и тромбоцитов и повышением вязкости крови, что затрудняет её перфузию через микрососуды.
Сладж может быть обратимым (только при агрегации эритроцитов) и необратимым (агглютинация эритроцитов).
Типы сладжа:
1. Классический – крупные размеры агрегатов, неровные очертания контуров и плотная упаковка эритроцитов;
2. Декстрановый – различная форма и величина, округлые очертания, плотная упаковка;
3. Аморфный грануловидный – мелкие агрегаты в виде гранул, состоящих из нескольких эритроцитов.
Сладж à резкое замедление кровотока, сепарация плазмы от эритроцитов, маятникообразные движения плазмы à стаз.
В связи с закупоркой терминальных артериол большим количеством агрегатов, капиллярные сосуды пропускают только плазму. При этом повреждается стенка сосудов (набухание, десквамация эндотелия).
Параллельно с процессами сладжирования и предшествуя им происходит нарушение проницаемости сосудов обмена (капилляры, венулы) в сторону её повышения. Это приводит к выходу жидкой части крови в интерстиций и сгущению крови, что усиливает процессы агрегации эритроцитов.
Морфологической основой проницаемости сосудов является эндотелий и базальная мембрана + периваскулярная ткань = неспецифический гистогематический барьер.
В морфологическом отношении повышение сосудистой проницаемости характеризуется увеличением промежутков между эндотелиоцитами вследствие сокращения и усиления везикулярного транспорта.
Раннее повышение проницаемости связано с воздействием биологически активных аминов и брадикинина, позднее (более 60 минут) – протеаз, каллидина, глобулярных веществ нейтрофилов. Действие этих веществ направлено на стенку капиллярных сосудов – межклеточный цемент эндотелия и базальную мембрану и заключается в физико-химических изменениях (деполимеризация сложных белково-полисахаридных комплексов).
Схема патогенеза шока
Клиническая картина
Шок развивается на фоне нарастания интоксикации: у больного появляется озноб, за которым следует резкий подъем температуры, часто наблюдается тошнота, рвота, диарея, состояние прострации.
В клиническом плане выделяют следующие группы симптомов, определяющих степень тяжести и прогноз.
|
№ |
Критерии септического синдрома |
| 1. | Клинические признаки инфекции |
| 2. |
Температура тела выше 38о С или ниже 36о С |
| 3. | Частота дыхания > 20 в минуту |
| 4. | Число сердечных сокращений > 90 в минуту |
| 5. |
Количество лейкоцитов больше 12,0х109/л или меньше 4,0х109 /л или при 10% незрелых форм |
| 6. |
1 или более изменений со стороны следующих органов: - нарушение сознания; - Ро2 < 70 мм рт. ст.; - олигоурия < 30 мл/час; - увеличение уровня лактата. |


