 Реферат: Исследование некоторых физико-химических свойств протеиназы Penicillium wortmannii
Реферат: Исследование некоторых физико-химических свойств протеиназы Penicillium wortmannii
Исследования термической инактивации протеиназы 1 при различных значениях рН позволили рассчитать константы инактивации для температур 30, 40, 50, 60оС, а затем найти термодинамические параметры этого процесса.
Термодинамические расчёты были проведены только для вышеуказанных температур (табл.3).
Таблица 3.
Термодинамические характеристики активированного комплекса
протеиназы I.
|
t, oC |
PH |
Еакт |
DН¹ |
DF¹ |
DS Дж*К-1*моль-1 |
|
Дж*моль-1 |
|||||
| 30-60 | 5,0 | 245,8 | 244,6 | 53,2 | 600,3 |
| 30-40 | 7,0 | 75,6 | 72,0 | 68,1 | 13,6 |
| 40-60 | 7,0 | 300,5 | 298,2 | 60,0 | 734,9 |
| 30-40 | 9,0 | 72,4 | 71,0 | 69,9 | 9,9 |
| 40-60 | 9,0 | 295,9 | 294,1 | 60,0 | 723,9 |
| 30-40 | 11,0 | 255,9 | 253,6 | 54,9 | 624,3 |
Поскольку инактивация протеиназы была необратимой, для определения энтальпии DН¹, свободной энергии DF¹ и энтропии DS¹ воспользовались теорией абсолютных скоростей Эйринга.
При повышении температуры скорость инактивации возрастает. Это можно объяснить тем, что тепловая энергия разрушает гидрофобные взаимодействия, которые играют важную роль в стабильности белков. В результате происходит развёртывание полипептидной цепи, что подтверждается высокими значениями DS¹ и согласуется с литературными данными.
Таким образом, изменение величины рН вызывает разрушение электростатических сил, и решающую роль в этих условиях в процессе инактивации играют, по-видимому, гидрофобные взаимодействия.
3.6 Влияние ионов металлов и ингибиторов на активный центр фермента.
Главным признаком, используемым при отношении протеолитических ферментов к тому или иному классу, является строение каталитического центра.
Отправной точкой в изучении строения активного центра, механизма катализа является идентификация функциональных групп, что достигается комплексными исследованиями и, в первую очередь, применением специфических ингибиторов. В наших опытах в качестве ингибиторов были использованы ЭДТА, монойодуксусная кислота, n-хлормеркурийбензоат натрия, фенилметилсульфатонилфторид, диизопропилфторфосфат, перманганат калия.
Растворы ферментов, содержащие 5×10-3М этих соединений, выдерживали при 30оС в течение одного часа.
Как показали результаты опытов, протеиназа 1 полностью инактивировалась ЭДТА – ингибитором металлоферментов, остальные ферменты не изменяли протеолитическую активность.
Протеиназа 2 инактивировалась монойодуксусной кислотой и n-хлормеркурийбензоатом натрия на 84 и 63% соответственно. Фермент терял активность при воздействии фенилметилсульфатонилфторидом и диизопропилфторфосфатом, это даёт возможность предположить, что протеиназа 2 относится к «сериновым». Не оказывал влияния не на одну из протеиназ перманганат калия, что свидетельствует об отсутствии в активном центре карбоксильной группы.
На основе полученных данных можно предположить, что протеиназа 1 относится к «металлоферментам», а протеиназа 2 – к «сериновым».
В дальнейшем было интересно рассмотреть влияние на протеиназы гистидина. На протеиназу 2 он не оказывал ингибирующего действия, в то время как полностью ингибировал протеолитическую и коллагеназную активности протеиназы 1. Из литературы известно, что гистидин является ингибитором коллагеназ. В связи с чем очевидно, что протеиназа 1 является ферментом, проявляющим свойства протеиназы с коллагеназным действием..
К специфическим реагентам относятся также ионы металлов. Они могут оказывать ингибирующий или активирующий эффект. В наших опытах мы использовали соли двухвалентных металлов в виде хлоридов и концентрации 0,005М. Фермент выдерживали в соли, а затем определяли остаточную активность. Ионы Mn2+, Ca2+, Ba2+ практически не оказывали никакого влияния на активность обеих протеиназ; Zn2+, Co2+ незначительно ингибировали оба фермента, ионы Cd2+, Cu2+ ингибировали протеиназу 1, а протеиназа 2 ингибировалась ионами Fe2+, Ni2+, Cd2+, Cu2+ . Результаты представлены в таблице 4.
Таблица 4.
Влияние ионов металлов на активность протеиназ Penicillium wortmannii 2091.
| Ион металла С=0,005М | Ферментная активность, % от исходной. | |
| Протеиназа I | Протеиназа II | |
|
Mn2+ |
100,0 | 95,39 |
|
Ca2+ |
100,0 | 100,0 |
|
Ba2+ |
100,0 | 100,0 |
|
Zn2+ |
95,2 | 95,2 |
|
Co2+ |
93,9 | 95,2 |
|
Cu2+ |
34,5 | 19,2 |
|
Cd2+ |
20,4 | 20,8 |
|
Ni2+ |
98,5 | 67,5 |
|
Fe2+ |
97,9 | 44,9 |
3.7 Субстратная специфичность.
В изучении протеолитических ферментов значительное место занимают исследования специфичности их действия. В литературе нет сведений, касающихся вопроса специфичности действия протеиназ грибов рода Penicillium. В связи с этим исследовалась способность протеиназы 1 к гидролизу некоторых пептидных связей.
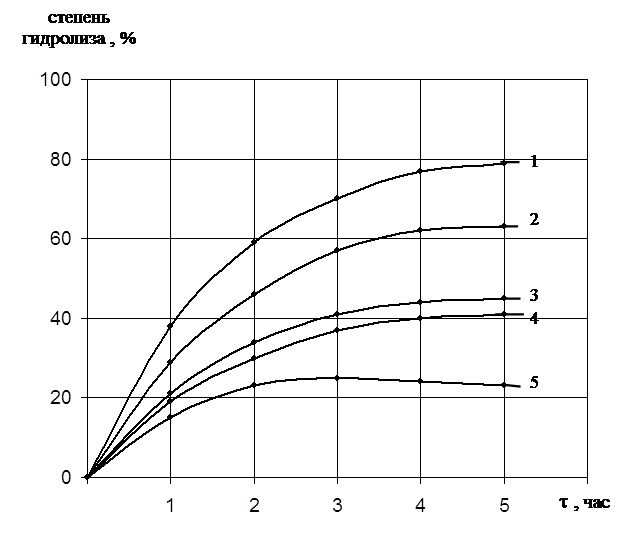
Исследования проводили на синтетических пептидах и различных белках. Результаты показали, что протеиназа 1 гидролизовала довольно широкий спектр пептидных связей. Она разрывала связи в пептидах: цис – ала, про – ала, гли – лей, гли – мет, ала – гли – гли, ала – гли – фен. Следует отметить, что гидролизу подвергались связи, характерные для белков животного происхождения. В связи с этим мы исследовали специфичность действия протеиназы на животных белках. В качестве субстратов использовались: казеин, гемоглобиин, денатурированный мочевиной, кератин, коллаген, желатина. При одной и той же концентрации фермента наиболее активно расщепляется казеин (78 – 80%) и гемоглобин (60 – 62%), затем слабее желатина и коллаген. Менее всего гидролизу подвергается кератин (22 – 25%) (рис.5).
3.8 Гидролиз коллагенсодержащего сырья: ноги птиц, шквара.
Мясная промышленность располагает значительным количеством шквары, получаемой при перетопке говяжьего и свиного жиросырья. Анализ химического состава шквары свидетельствует о значительном содержании в ней белковых веществ и подтверждает целесообразность её использования как в колбасном, так и ряде других производств. Общее содержание белка в шкваре колеблется в пределах 65 – 80%. В состав белков входят 22 – 44% коллагена и 19 – 30% эластина. Однако использование шквары ограничивалось из-за большого содержания соединительной ткани. В настоящее время соединительную ткань рассматривают не как билластное вещество, а как необходимый компонент питания [10]. В связи с этим возрастает практический интерес к рациональному и полному использованию шквары на пищевые цели, разработке путей повышения её биологической ценности. Это направление явилось основой разрабатываемой нами темы.
Для получения гидролиза шквары целесообразно использование протеиназ, расщепляющих белки в нейтральной зоне рН и действующих на коллаген.
 |
|||
Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 |
|||


