 Реферат: Вода и ее применение в современных технологиях
Реферат: Вода и ее применение в современных технологиях
Скрытая теплота парообразования (539 кал/г) почти в 7 раз выше, чем скрытая теплота плавления. Чтобы превратить жидкую воду с температурой 100 °С в пар с такой же температурой, нужно затратить поистине гигантскую энергию, в то время как '/з этой энергии вполне достаточно, чтобы превратить в пар спирт, и '/в, чтобы жидкую ртуть сделать парообразной. Можете теперь себе представить, какой громадной внутренней энергией в скрытой форме обладает водяной пар, и это только при 100 °С! А если его нагреть до 500 °С, то 1 г его потенциально будет содержать порядка 1000 кал тепла. К сожалению, реализовать эту скрытую энергию практически очень трудно.
Как известно, пар используется в паровых машинах, которых становится все меньше и меньше из-за исключительно низкого (ниже) к. п. д. и не только в силу невозместимых естественных потерь на трение, излучение, теплопроводность и других, но и по причинам малой разности температур между границами существования воды, а также малого контраста между температурой окружающего воздуха и точкой парообразования. Эти обстоятельства в настоящее время заставляют заменить паровые двигатели двигателями внутреннего сгорания, электрическими и другими.
Что же касается скрытой теплоты парообразования, то тут аномальности не наблюдается. Чем холоднее жидкая вода, тем больший приток тепла нужен ей, чтобы обратить ее в пар. Так, при 0°С теплота парообразования 587 кал, при 50 °С — 568, а при 100 °С — 536, при 150 °С — 446 кал.
1.5 Поверхностное натяжение и прилипание.
Поверхностное натяжение — это способность пограничных молекул воды, а также твердых тел сцепляться, «стягиваться», самоуплотняться (когезия). На поверхности воды образуются сцепления молекул, создающие пленку натяжения, для разрыва которой потребуется немалая сила. На этой пленке могут лежать, не погружаясь в воду, предметы, которые в 8 раз и более тяжелее воды, например лезвие безопасной бритвы, иголка и др. Поверхностное натяжение воды при 18°С составляет 72 дин/см— это очень высокое значение (сравните: для спирта оно составляет 22, для ацетона 24, для бензина 29 дин/см). Только ртуть имеет еще более высокое поверхностное натяжение — 500 дин/см.
Теоретически установлено, что для разрыва столбика чистой воды диаметром 2,5 см потребуется приложить усилие 95 те. Поскольку, как уже упоминалось выше, совершенно чистой воды в природе нет, да и в лабораторных условиях получить ее почти невозможно, то в условиях эксперимента с не совсем чистой водой для разрыва столбика воды сечением 6,5 см2 потребуется усилие в пределах «только» 1 те, что близко к прочности стали.
У воды есть и еще одно удивительное свойство — «прилипание» (адгезия), которое можно наблюдать в узких стеклянных трубках (капиллярах), где вода
Поднимается вверх вопреки силам притяжения (гравитации). В таких трубках
сочетаются силы сцепления молекул воды в пограничном с воздухом слое со
способностью воды смачивать стекло, «прилипать» к нему. В результате в
капилляре образуется вогнутая поверхность выше естественного уровня воды. У ртути,
обладающей более высоким поверхностным натяжением, адгезия отсутствует,
поэтому ртуть в капиллярной трубке имеет не вогнутую, а выпуклую поверхность.
Необходимо заметить, что к поверхностям, покрытым жировым слоем, например
парафином, вода не прилипает и мениск ее в капилляре, подобно мениску ртути,
будет не вогнутый, а выпуклый.
Существует понятие капиллярной постоянной, которая равна произведению высоты подъема жидкости на радиус капилляра. Капиллярная постоянная для чистой воды линейно уменьшается с увеличением температуры, а при достижении критической (см. ниже) становится равной нулю. Предельная высота капиллярного подъема воды при 15 °С составит в крупном песке около 2, в мелком 1,2 м, а в чистой глине 12 м, причем продолжительность подъема для крупных капилляров—5—10 суток, а для мелких до 16 месяцев.
1.6 Теплоемкость воды.
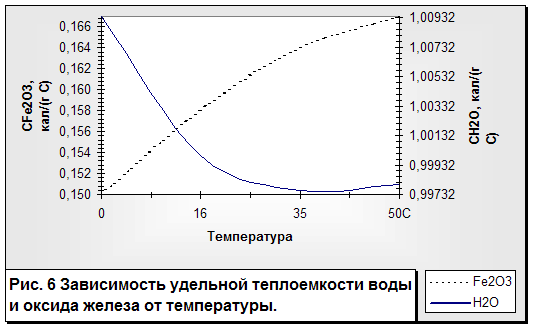
Остановимся на следующей аномалии воды, которая связана с ее теплоемкостью. Теплоемкость воды сама по себе не аномальна, но она в 5—30 раз выше, чем у других веществ. У всех тел, кроме ртути и жидкой воды, удельная теплоемкость с повышением температуры возрастает. У воды же удельная теплоемкость в интервале температур от 0 до 35 °С. падает, а затем начинает возрастать (рис. 6).
Удельная теплоемкость воды при 16 °С условно принята за 1 и служит, таким образом, эталоном меры для других веществ. Как и плотность, удельная теплоемкость воды в зависимости от температуры не однозначна, а двузначна. Например, при 25 и при 50 °С она одинакова — 0,99800 кал/(г-°С). Теплоемкость льда на интервале от 0 до минус 20 °С в среднем 0,5 кал/(г-°С), т. е. в два раза меньше, чем у
Только водород и аммиак обладают большей, чем вода, теплоемкостью. жидкой воды. Удельная теплоемкость спирта и глицерина—0,3 (в три раза меньше, чем у воды), железа—0,1, платины—0,03, дерева—0,6, а каменной соли и песка—0,2 кал/(г-°С). В связи со сказанным выше становится попятным, почему при одинаковом получении солнечного тепла вода в водоеме нагреется в b раз меньше, чем сухая песчаная почва на берегу, но при этом вода во столько же раз дольше будет сохранять тепло, нежели песок. Любопытно, что теплоемкость воды в переохлажденном состоянии (например, при - 7,5 °С) на 2% выше, чем при той же температуре, но уже в кристаллическом состоянии.
Мы ежедневно слышим по радио сообщения об атмосферном давлении воздуха (наряду с сообщением о температуре, влажности, силе ветра и т. д.), нормальное значение которого для высоты Ленинграда над уровнем моря 760 мм рт. ст., а для Москвы, лежащей выше уровня моря на 124 м, 758 мм рт. ст. Мы все привыкли к тому, что при падении давления ниже нормы можно ожидать дождя, а при подъеме выше нормы – сухой погоды. Хотя с метеорологической точки зрения сухая и влажная погода определяются комплексом условий, а не одним только давлением. Многие люди, вероятно, помнят, что на старых анероидах помимо шкалы с делениями на миллиметры ртутного столба, были надписи: «великая сушь», «сушь», что отвечало давлению, превышающему норму, для данной местности, «переменно» — для нормального давления, «дождь», «буря» — для давления ниже нормы.
Вдумайтесь в сказанное. Ведь конденсация водяных паров в жидкость по законам физики должна происходить при увеличении давления, а при его падении процесс должен протекать в обратном направлении, т. е. жидкость должна превращаться в пар. В чем же здесь дело? Для ответа нам придется рассмотреть особенности удельной теплоемкости паров воды. При давлении 1 атм и температуре 100 °С из 1 л воды образуется 1600 л пара. Для определения удельной теплоемкости пара ограничим его состояние двумя случаями: пар находится либо в замкнутом объеме, либо в сосуде, позволяющем пару расширяться при передаче ему тепла при сохранении постоянного давления. В последнем случае температура и объем меняются.
Теплоемкость пара для принятых условий разная, и эта разница весьма существенна, причем не только для воды, но и для многих других веществ, например у ртути до 20%. Но при этом у воды обнаруживается аномалия: при 4°С теплоемкость в обоих случаях одинакова и лишь с повышением температуры она становится разной. При этом минимальная теплоемкость наблюдается при постоянном давлении и при температуре 27 °С, а при постоянном объеме такого минимума не наблюдается и с повышением температуры теплоемкость постепенно снижается. Заметим, что одна и та же масса воды, находящейся в парообразном состоянии, может быть нагрета в два-три раза легче, чем та же масса жидкой водой. Еще раз напомним, что объемы этих двух фаз воды относятся друг к другу, как 1600 : 1.
А теперь рассмотрим эти же два случая (определение теплоемкости при постоянном объеме и при постоянном давлении) для насыщенного пара. В принятых нами условиях возможно изменение температуры и превращается в мельчайшие капельки тумана.
Проведем с насыщенным паром, следующий опыт. Сосуд с насыщенным паром защитим от случайного поступления или потери тепла (теплоизолируем). При изменении давления в сосуде, казалось, можно ожидать один из двух случаев: либо при повышении давления (и уменьшении объема пара) он станет перенасыщенным с образованием тумана, либо в результате увеличения температуры он перегреется. Что же надо сделать, чтобы привести пар в первичное состояние? При перенасыщении его следует дополнительно нагреть (т. е. сообщить положительное количество тепла), при недонасыщении нужно от него отнять тепло, охладить (т. е. сообщить ему отрицательное количество тепла). В первом случае теплоемкость будет положительной, а во втором отрицательной. И вот в действительности оказывается, что теплоемкость насыщенного водяного пара при всех температурах и давлениях всегда отрицательная!
Этот поразительный и малопонятный результат эксперимента имеет место не только в лабораторных условиях, но и в природе. При повышении давления водяной газ (пар) не образует тумана и остается прозрачным, а при разрежении туман образуется. Правда, последнее происходит при наличии центров конденсации (пылинок), но их в атмосфере всегда достаточно.
Помимо описанных аномалий у этого удивительного вещества, каким является вода, существуют и другие аномалии (например, аномальная дисперсия, рассеяние, в области электрических и световых лучей и др.), но на них, чтобы не утруждать читателя, мы останавливаться не будем.
1.7 Испарение, транспирация, сублимация и конденсация.
Общеизвестно, что испарение—переход вещества из жидкого или твердого состояния в газообразное (в пар). Обычно под испарением жидкости понимают превращение ее в пар, а испарение твердых тел называется сублимацией (или возгонкой). Обратный процесс, т. е. переход вещества из газообразного состояния в жидкое, именуется конденсацией. Испарение воды с поверхности растений носит название транспирации.


