 Реферат: Вода и ее применение в современных технологиях
Реферат: Вода и ее применение в современных технологиях
Можно было бы предполагать, что атом кислорода и два атома водорода в молекуле воды образуют у центрального атома кислорода угол, близкий к 180°. Однако в действительности он значительно меньше — всего 104° 27' (рис. 2), что приводит к неполной компенсации внутримолекулярных сил, избыток которых обусловливает асимметрию распределения зарядов, создающую полярность молекулы воды. Эта полярность у воды, более значительная, чем других веществ, обусловливает ее дипольный момент и диэлектрическую проницаемость. Последняя у воды весьма велика и определяет интенсивность растворения водой различных веществ. При 0°С диэлектрическая проницаемость воды (в твердой фазе) составляет 74,6; с повышением температуры она падает. Так, при 20° С диэлектрическая проницаемость воды равна 81.
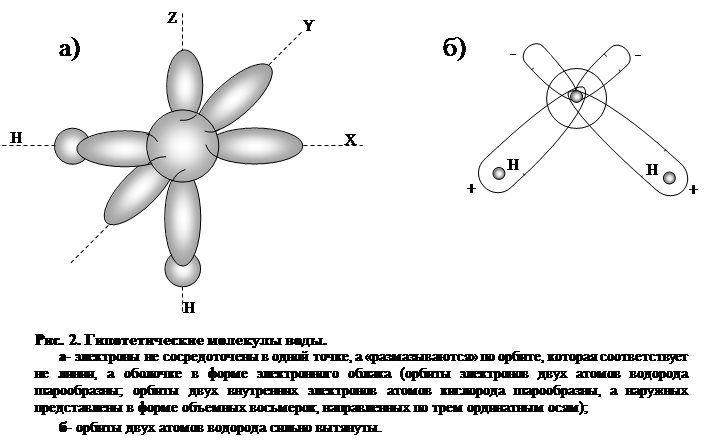
Многочисленные схемы строения молекулы воды являются
гипотетическими, построенными на косвенных наблюдениях приборами некоторых
признаков поведения и свойств молекул и атомов. При этом следует помнить, что
ни атомы, ни молекулы не имеют четких границ размеров орбит, по которым
движутся электроны, образующие по сути дела электронное облако, зависящее от
энергетического состояния электрона (рис.2).
1.2
 |
Плотность.
Несмотря на то что вода — вещество, принятое в качестве эталона меры плотности, объема и т. д. для других веществ, сама вода, как это не странно, является самым аномальным среди них. Этих удивительных аномалий у воды много, рассмотрим лишь основные из них.
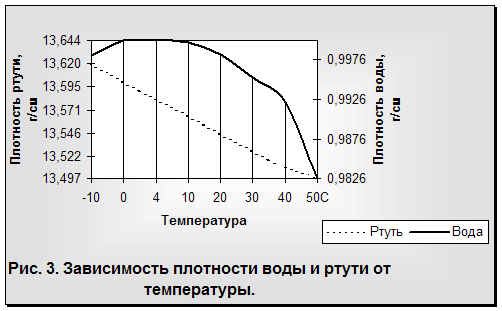
Общеизвестно, что все вещества при нагревании увеличивают свой объем и уменьшают плотность. У воды наблюдается то же самое, за исключением интервала от 0 до 4°С, когда с возрастанием температуры объем воды не увеличивается, а, наоборот, сокращается. Максимальная плотность отмечается при 4°С (рис. 3). Таким образом, для воды зависимость между объемом и температурой не однозначна (как в нормальных условиях для других веществ), а двузначна. Например, при 3 и 5°С масса воды занимает один и тот же объем, так же как и при 0, 2 и 8 °С и т. д. Несмотря на указанную аномалию, вода служит эталоном плотности при 4°С, когда 1 см3 ее имеет массу 1 г.
Что же будет происходить с объемом воды при дальнейшем понижении температуры? Оказывается, что ниже 0°С он продолжает увеличиваться, но только при условии переохлаждения. Однако переохлаждение требует исключительных условий: полной неподвижности воды и отсутствия центров кристаллизации льда (пыли, кристалликов льда и т. п.) (рис. 4).
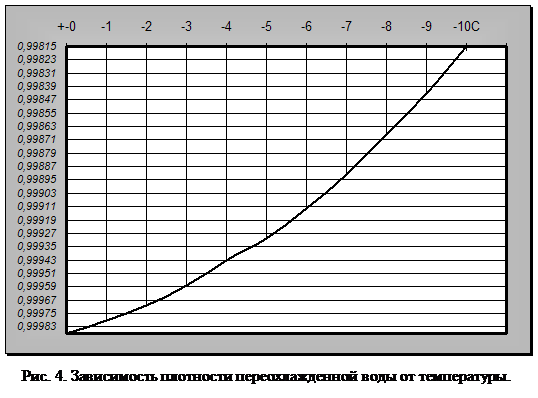
Вода, лишенная растворенных газов, может быть переохлаждена
до минус 70 °С без превращения в лед. При легком встряхивании либо при введении
льдинки или другого центра кристаллизации она мгновенно превращается в лед и
температура ее подскакивает (на 70 °С) до 0°С. Вода также может быть доведена
до 150 °С без закипания. При введении в такую перегретую воду пузырька воздуха
она мгновенно вскипает, и температура ее падает до 100°С.
При замерзании объем воды возрастает внезапно примерно на 11% и так же внезапно, скачком, уменьшается в обратном направлении при таянии льда при
превращении ее в лед происходит расширение объема, что приводит к возникновению избыточного давления, достигающего, как показывают наблюдения, 2500 кгс/см2. Именно этим объясняются как разрушительная сила замерзающей воды в замкнутых пустотах, трещинах горных пород, откалывающая подчас многотонные глыбы и дробящая их в дальнейшем на мелкие осколки, так и страшные взрывы наледей, описание которых будет приведено ниже, а также разрывы водопроводных труб при замерзании в них воды.
Здесь следует сделать одну существенную оговорку. Все рассмотренные выше процессы происходят при указанных температурах лишь при условии абсолютного давления, равного 1 атм. С увеличением давления температура замерзания воды понижается примерно на 1 °С через каждые 130 атм. Так, при давлении 500 атм замерзание наступает при температуре минус 4 °С, а при давлении 2200 атм — при минус 22 °С. Эта зависимость для воды аномальна, так как у других веществ, наоборот, с ростом давления температура замерзания повышается. Подобная аномалия воды очень важна в природе. Даже без учета растворенных в воде солей на больших глубинах в океане вода не замерзает, например при температуре минус 3°С она не замерзнет даже на глубине около 4000 м, а на больших глубинах тем более.
С повышением температуры жидкой воды ее плотность понижается: на интервале от максимальной плотности при 4°С, равной 1, до точки кипения воды 100 "С—на 4% (от 1 до 0,95838).
С повышением минерализации воды (т. е. количества содержащихся в ней минеральных веществ) повышается и температура, при которой вода имеет максимальную плотность. Так, на поверхности Мирового океана плотность воды 1,02813, а на глубине 10км 1,07104 (разница 0,04291, или 4%). Таким образом, установившееся мнение о практической несжимаемости воды справедливо только для сравнительно малых давлений. Если бы вода была совершенно несжимаема, уровень океана поднялся бы на 30 м.
В этом случае большая часть Ленинграда, например, была бы затоплена.
Важным обстоятельством в природе является то, что максимальная плотность воды, как отмечалось выше, наблюдается при 4 °С, а лед оказывается легче жидкой воды и поэтому плавает на ее поверхности. Если бы этого не было, то водоемы и водотоки промерзали бы зимой до самого дна, что было бы настоящей катастрофой для всего живого в них. Впрочем, эта особенность воды при некоторых условиях имеет исключения. Речь идет о возможности образования донного или внутриводного льда, о чем подробнее будет сказано в разделе о поверхностных водах.
1.3 Точки кипения и замерзания (плавления).
Что касается температуры кипения, то она находится в прямой зависимости от давления: с увеличением давления она возрастает (рис. 5). Это свойство воды раньше использовалось для определения высоты местности в горах. Температура кипения повышается также с увеличением содержания в воде растворенных веществ.
Иная зависимость наблюдается между давлением и точкой замерзания (плавления) воды, с повышением давления она падает (но только до давления 2200 атм). При дальнейшем увеличении давления точка замерзания воды начинает расти: при давлении 3530 атм вода замерзает при минус 17; при 6380 атм—при 0°С, при 16500 атм—при 60, а при 20 670 атм — при 76 °С. В последних двух случаях мы уже имеем горячие льды. Возможно ли существование в земных недрах сочетания таких температур и давлений? В свободно циркулирующих в породах Земли водах, безусловно, нет, так как даже на границе нижней литосферы и верхней мантии, называемой границей Мохоровичича (как мы увидим из дальнейших глав), где давление приблизительно 10000 атм, температура никак не может быть равна 30 "С,
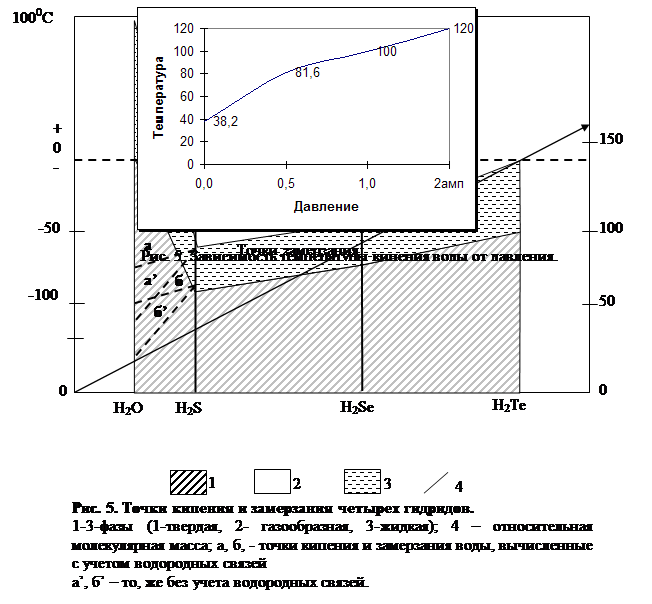
а всегда и везде будет значительно выше. Таким Образом, встреча горячего льда
здесь исключается. Выше же границы Мохоровичича совершенно исключаются
давления выше 6000 атм, которые необходимы для образования горячего льда.
При давлении 1 атм аномальны точки замерзания (плавления) и кипения воды (соответственно 0 и 100°С). Если взять ряд соединений водорода с элементами группы Via периодической системы Менделеева — Н2Те, H2Se H2S и H2O — с учетом их относительной молекулярной массы, то окажется, что точки замерзания и кипения воды не укладываются в закономерность, общую для трех других соединений, у которых чем больше относительная молекулярная масса, тем выше точки кипения и замерзания. Точка замерзания воды должна была бы находиться между минус 90 и минус 120 °С, а в действительности она приходится на ±0 °С. То же самое можно сказать о точке кипения воды, которая должна была бы быть между 75 и 100 °С (рис. 5).
При нормальном давлении вода может «замер-рать» и при положительной температуре. Это наблюдается, например, в газопроводе, когда проходящий по нему газ (в основном метан) плохо осушен, т.е. в нем присутствует вода. Объем молекулы газа по сравнению с объемом молекулы воды значительно больше, что приводит к понижению внутреннего давления и к повышению температуры замерзания от нескольких градусов до 20 °С. Выпадающий «лед» содержит много газа (газогидрат).
Сам факт существования воды в обычных для земной поверхности термодинамических условиях во всех трех фазах (твердой, жидкой и газообразной) делает это вещество крайне удивительным и необыкновенным.
1.4 Теплота плавления.
Познакомимся с еще одной аномалией воды, называемой, может быть, не очень удачно «скрытой теплотой плавления воды». У воды она очень высока — около 80 кал/г (для сравнения «скрытая» теплота плавления чистого железа — 6, серы—9,5 и свинца—5,5 кал/г). Как же проявляется эта аномалия? Лед при давлении 1 атм может иметь температуру от минус 1 до минус 7°С. Казалось бы, чем ниже температура льда, тем больше потребуется тепла, для того чтобы растопить его. Этот вывод как будто настолько естествен, что непосвященный в физику тепла вряд ли станет его оспаривать. Но, оказывается, этот вывод не бесспорен. Например, при температуре льда 7°С ниже нуля скрытая теплота плавления составит не 80, а только 76 кал/г! Вот это уже бесспорная и довольно неожиданная аномалия. С каждым градусом понижения температуры льда теплота плавления уменьшается чуть ли не на полкалории. Объясняется это тем, что удельная теплоемкость у льда меньше, чем у воды.


