 Реферат: Химия и экология
Реферат: Химия и экология
Фреоны являются распространенными хладагентами в холодильниках и кондиционерах, используются как носители активных химикатов (пропелленты) в аэрозольных баллончиках, получивших широкое распространение в быту. В такой удобной для дозировки упаковке выпускают множество продуктов — лекарства, краски, косметические средства, моющие препараты, инсектициды и др. При получении пенопластов фреоны применяют для формирования полостей и пузырьков. Ряд фреонов используют как компоненты огнетушащих составов в системах автоматического пожаротушения, например фреон 13В 1. Некоторые фреоны являются незаменимыми растворителями C2Cl3F3. К 1975 г. мировое производство фреонов достигло 800 тыс. т в год.
Трудно было предположить, что эти, казалось бы безвредные, соединения могут представлять серьезную угрозу для биосферы в целом. Однако, оказалось, что фреоны, будучи химически инертными соединениями, при попадании в тропосферу не разрушаются в ней. Ученые установили, что время удаления фреонов из океана, обусловленное гидролизом или микробиологическим разрушением после перехода поверхности газ-жидкость, составляет для ферона 11 — 70 лет, фреона 12 — 200 лет. Действие почвенных микроорганизмов также незначительно, так как время удаления фреонов из почвы под их воздействием превышает 10 тыс. лет. Это означает, что попавшие в тропосферу фреоны медленно диффундируют в стратосферу. Сами по себе фреоны не представляют опасности для озонового экрана, так как эти вещества инертны по отношению к озону. Однако специальные наблюдения с помощью воздушных шаров показали, что свободно мигрирующие в тропосфере без больших потерь фреоны в стратосфере на уровне более 20 км подвергаются фотохимическому распаду, выделяя
![]() CF2Cl2
hv CF2Cl* + Cl*
CF2Cl2
hv CF2Cl* + Cl*
![]() CFCl3
hv CFCl2* + Cl*
CFCl3
hv CFCl2* + Cl*
длина волны = 185-225 нм
Атомы хлора действуют как сильные катализаторы распада озона.
В разрушении фреонов, кроме УФ-излучения солнца, участвует также атомарный кислород в возбужденном состоянии, образующийся при фотодиссоциации озона. По механизму действия на озоносферу к фреонам близки и некоторые органические растворители, например ССl4 или CH3CCl3.
Галогензамещенные углеводороды, содержащие атомы водорода (CH3CCl3, CHClF2 и др.), окисляются и гидроксильным радикалом НО и поэтому имеют более короткое время жизни в атмосфере. Это время определяется как отношение содержания данного вещества в определенном объеме к интенсивности его уменьшения в этом объеме. Среднее время жизни, по данным ученых, составляет для фреона 11 и 12 около 80 лет, СС14 — 50 лет, СН,СС13 — около 10 лет. Очевидно, что даже при гипотетическом полном прекращении всех выбросов фреонов в атмосферу их содержание будет достаточно высоким еще и в XXI в. При сохранении же современной скорости уменьшения выброса галогенсодержащих углеводородов (на 10 % в год) к середине XXI в. содержание активных соединений хлора в атмосфере увеличится в 10 раз и более по сравнению с уровнем
50-х гг. до начала промышленного производства фреонов.
Осознание этой опасности побудило ряд государств значительно сократить или вовсе прекратить производство и применение фреонов. Так, в качестве пропеллентов для аэрозолей начали использовать пропан, который хотя и горюч, но дешевле фреонов и не опасен по своим отдаленным последствиям. Для холодильников предложены менее летучие фторхлорпроизводные углеводороды, например фреон 113 (tКИП = 47,7 °С) вместо фреона 12 (tКИП = 29,8 °С). Таким образом, человечество уже делает первые конкретные шаги для сохранения озонного щита планеты.
Хлорароматические соединения как глобальные загрязнители
Химическая устойчивость ароматических углеводородов и их высокая токсичность обусловливают повышенную опасность этих веществ при попадании их в окружающую среду. В природе имеются микроорганизмы, способные разрушать ароматические ядра до соединений, которые, включаясь в природный круговорот, в конечном итоге превращаются в СО2 и Н2О. Однако микробиологическому разрушению подвергаются кольца, содержащие по крайней мере 2 гидроксильных заместителя в орто- или параположениях. Если же ароматические углеводороды устойчивы к окислению, то опасность их при попадании в природную среду резко возрастает из-за их способности накапливаться в живых организмах. К таким веществам относятся бензол, третбутилбензол, конденсированные ароматические углеводороды и т.д. Так, известно, что первый представитель ароматических углеводородов — бензол представляет опасность для человека. Продолжительное вдыхание даже небольших количеств паров бензола вызывает хроническое отравление, утомляемость, головные боли, сонливость, нарушение кровообращения и нормального состава крови. Функциональные производные бензола также опасны для живых организмов. Например, фенол является нервным ядом, обладает прижигающим и раз-
дражающим действием. Фенол легко всасывается через кожу, при длительном воздействии на кожу опасны
даже 2—3 %-е растворы фенолов и особенно его пары. Однако приоритетными загрязнителями окружающей среды в настоящее время являются хлорароматические соединения. Это обусловлено широким использованием в сельском хозяйстве таких средств защиты растений от вредителей и болезней, как ДДТ, линдан, гербициды на основе хлорфеноксикарбоновых кислот.
Источником хлорзамещенных ароматических углеводородов являются также антисептики на основе
пентахлорфенола, полихлорированные бифенилы и полихлорнафталины, применяемые в качестве него-
рючих изоляционных жидкостей в трансформаторах, пластификаторов, пластмасс, лаков и лакокрасочных
материалов. Эти соединения используются также в качестве материалов-носителей, растворителей пес-
тицидов.
Хлорароматические соединения обладают рядом общих свойств, которые выделяют их среди других органических загрязнителей, острым токсическим действием на человека и животных, устойчивостью к разложению при попадании в почву, воду, воздух и способностью мигрирования в них, способностью накапливаться самих хлорорганических соединений или их еще более токсичных метаболитов в органах и тканях живых организмов.
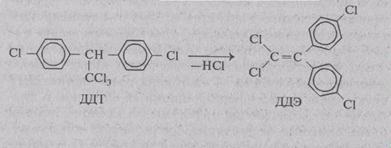
При использовании дихлордифенилтрихлорметил-метана — ДДТ возникла настоящая экологическая
проблема. Это вещество впервые было синтезировано и предложено в качестве средства борьбы с вреди-
телями сельского хозяйства в 1940 г. швейцарским химиком Паулем Мюллером, удостоенным за эту ра-
боту Нобелевской премии. Казалось, что применение этого вещества позволит человечеству справиться со
многими проблемами -- благодаря применению ДДТ резко уменьшился ущерб, наносимый саранчой и дру-
гими насекомыми-вредителями, миллионы людей были спасены от малярии, разносимой комарами.
Однако вскоре изумление перед мощью ДДТ изменило радужную окраску на трагическую. Оказалось, что
 ДДТ вредно действует
на все организмы, включая водоросли. Уже при содержании его несколько час-
ДДТ вредно действует
на все организмы, включая водоросли. Уже при содержании его несколько час-
тей на миллиард падает скорость фотосинтеза, процесса, который является основным поставщиком
кислорода в атмосферу. Далее выяснилось, что ДДТ, как и многие другие пестициды, обладает кумулятив-
ным эффектом, вызывает тяжелые последствия — от токсических до мутагенных. Благодаря устойчивости
ДДТ, он накапливается и передается по пищевым цепям — от растений к травоядным животным, от них
к хищникам, при этом в каждом последующем звене пищевой цепи содержание ДДТ увеличивается в 10
раз. В результате накопления препарата его концентрация в организме, который никогда не соприкасался
с ядом, может достигнуть смертельных доз. Когда в США обнаружили, что в молоке кормящих матерей
концентрация ДДТ превышает в 4 раза предельно допустимую дозу, применение его было запрещено. В 1970 г. применение ДДТ запретили и в СССР. Однако в результате прежнего неограниченного применения ДДТ сегодня на Земле в биологическом круговороте находится около миллиона тонн этого препарата в силу чрезвычайно малой скорости его разложения (10 лет). Кроме того, в природной среде ДДТ способен превращаться в-еще более опасное соединение ДДЭ, поскольку последнее вещество еще медленнее, чем ДДТ метаболизируется и разрушается.
К сожалению, токсическое и мутагенное действие на организм человека свойственно не только ДДТ и ДДЭ, но и многим другим пестицидам.
Еще более опасны по своим отдаленным последствиям по сравнению с хлорированными ароматическими углеводородами полихлорированные полициклические соединения типа полихлордибензо-п-диоксинов и полихлордибензофуранов:
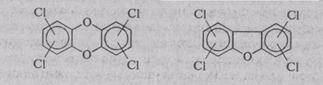
Известно, несколько десятков изомерных дибензо-п-диоксинов и дибензофуранов, содержащих от 1 до 8 атомов хлора в различных положениях и отличающихся друг от друга своими свойствами и токсичностью. Наиболее токсичными являются 2,3,7,8-тетрахлордибензо-п-диоксин и 2,3,7,8-тетрахлордибен-зофуран. Эти вещества обладают чрезвычайно высокой биологической активностью и высокой химической стабильностью в природе и живых организмах, свободно переносятся по цепям питания. Даже в ничтожных концентрациях эти соединения подавляют иммунную систему организмов, повышают тем самым чувствительность к инфекционным заболеваниям, особенно вирусным, снижают умственную и физическую работоспособность. При содержании несколько частей на триллион эти примеси оказывают мутагенное и канцерогенное воздействие, поражают нервную систему, нарушают детородные функции.
Накопление полихлорполициклических соединений началось в период развертывания производств гексахлорана и ДДТ, особенно после пуска производств полихлорфенолов и хлорированных дифенилов. Наибольшую известность проблема диоксинов получила в результате массовых поражений населения, животных и растений в Южном Вьетнаме, где с 1961 по 1971 гг. армией США было применено около 100 тыс. т гербицидов и дефолиантов, половину из которых составлял 2,4,5-Т, содержащий в своем составе до 100 ч на 1 млн 2,3,7,8-тетрахлордибензо-п-диоксина. Позже было установлено, что хлорированные диоксины образуются также на целлюлозных заводах при отбеливании пульпы хлором, в воде при ее хлорировании с целью обеззараживания. Диоксины выделяются также при неконтролируемом сжигании отходов, содержащих поливинилхлорид или не содержащих хлор органических веществ в присутствии веществ — доноров хлора. Так, обычная мусоросжигалка можетстать поставщиком этих ядовитых соединений в природную среду.
Страницы: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16


