 Реферат: Получение оксидов урана
Реферат: Получение оксидов урана
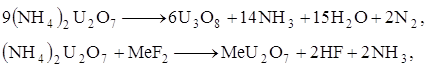 |
(сорбированный фторид аммония разлагается и улетучивается в виде фтористого водорода и аммиака). До температур примерно 700°С фтор практически не удаляется; заметное его отщепление происходит при температуре 900°С. При более высоких температурах (порядка 950 - 1000°С) фтор может быть удален почти количественно. Проведение процесса в кипящем слое связано с резким увеличением эффективности удаления иона фтора.
Получение оксидов урана из его пероксидов
Для получения оксидов урана методом прокаливания может быть использован пероксид урана UO4 . 2H2O, получающийся на одной из конечных стадий аффинажа урана и не содержащий нелетучих компонентов, кроме урана. При температуре около 400°С разложение пероксида на воздухе протекает по реакции
с образованием триоксида урана. Повышение температуры до 400 – 600°С связано с разложением пероксида урана или полученного из него триоксида урана до закиси-окиси урана по реакции:
Так же, как и при прокаливании диураната аммония, примеси в большинстве своем концентрируются в оксидах урана. Количественно удаляются лишь вода, кислород и азот в результате сорбированного из азотнокислого раствора иона NO3-.
Размеры частиц, а следовательно, удельная поверхность и реакционная способность получаемых оксидов зависят от условий прокаливания. Оптимальной температурой процесса принято считать 400 – 450°С.
Получение оксидов урана из оксалата уранила
Оксиды урана могут быть получены при термической диссоциации оксалата уранила, который в интервале температур 120 – 210°С теряет свою кристаллизационную воду. При дальнейшем повышении температуры до
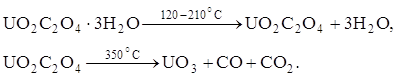 |
350°С идет образование триоксида урана:
При еще более высоких температурах 500 – 600°С разложение оксалата уранила в вакууме или инертной атмосфере сопровождается образованием диоксида урана, что обусловлено восстанавливающим действием оксида углерода:
Диоксид урана, полученный термической диссоциацией оксалата уранила, пирофорен, легко взаимодействует с газообразным фтористым водородом т плавиковой кислотой.
Получение оксидов урана из аммонийуранилтрикарбоната
Аммонийуранилтрикарбонат разлагается на воздухе при температуре 700 – 900°С с образованием закиси-окиси урана:
В этом же интервале температур, но в инертной атмосфере или под вакуумом разложение аммонийуранилтрикарбоната сопровождается образованием диоксида урана:
Роль восстановителя в данном случае играет диссоциирующий аммиак. Восстановление происходит вследствие диссоциации NH3. При соблюдении определенных условий удается получить диоксид урана состава UO2,05 – UO2,06, что удовлетворяет требованиям последующей операции гидрофторирования оксида для получения тетрафторида урана.
Восстановление высших оксидов урана до диоксида
Все рассмотренные методы получения оксидов урана давали в основном возможность получить высшие оксиды урана (триоксид и закись-окись урана). Для восстановления этих последних чаще всего используется водород или расщепленный аммиак при повышенных температурах. Прокаливание ниже 1000°С независимо от парциального давления кислорода приводит к образованию окисла урана состава UO2,61 – 2,64. Скорость отщепления кислорода от триоксида урана зависит от температуры (табл. 4). В течение всего процесса прокаливания эта скорость остается примерно постоянной. Следует отметить, что дальнейшее повышение температуры уже меньше сказывается на изменении скорости реакции, в связи с чем при производстве закиси-окиси урана поддерживают температуру около 800°С.
Таблица 4. Зависимость скорости отщепления кислорода
при прокаливании триоксида урана на воздухе от температуры
| Температура, °С |
Скорость отщепления кислорода, моль О2/моль U/мин |
| 500 | 0,007 |
| 590 | 0,031 |
| 640 | 0,086 |
| 800 | 0,192 |
Скорость реакции восстановления закиси-окиси урана водородом зависит прежде всего от температуры (табл. 5).
Таблица 5. Влияние температуры на скорость реакции
восстановления закиси-окиси урана водородом
| Температура, °С |
Скорость реакции восстановления, моль Н2/моль U/мин |
| 450 | 0,0021 |
| 470 | 0,0034 |
| 496 | 0,0067 |
| 525 | 0,0135 |
| 581 | 0,0320 |
| 597 | 0,0371 |
| 649 | 0,0467 |
| 705 | 0,0490 |
| 866 | 0,0473 |
Примечание. Реакция восстановления проведена при постоянном парциальном давлении водорода 400 мм рт. ст.; закись-окись урана получена ступенчатым прокаливанием пероксида урана при 250 –300°С до UO3 . 1/2H2O, а затем при 800°С до U3O8.
Начиная с температуры 650°С, скорость реакции больше не увеличивается, поэтому процесс восстановления закиси-окиси урана водородом целесообразно проводить в интервале температур 600 – 700°С, при этом парциальное давление водорода и степень восстановления закиси-окиси также оказывают влияние. С повышением парциального давления водорода скорость реакции восстановления закиси-окиси урана повышается, но сравнительно слабо, поэтому процесс проводится при давлении, близком к атмосферному.
Размер кристаллов закиси-окиси урана также влияет на скорость восстановления (табл. 6).
Таблица 6. Зависимость скорости восстановления закиси-окиси урана
водородом от среднего размера кристаллов
| Соединение, из которого получена закись-окись урана | Температура получения закиси-окиси урана, °С | Средний размер кристаллов, мкм |
Скорость восстановления закиси-окиси урана при 380°С, мольН2/мольU/мин. |
Скорость восстановления закиси-окиси урана при 545°С, моль Н2/мольU/мин. |
|
UO2C2O4 |
<650 | ~0,1 | 0,0023 | 0,036 |
|
(NH4)2U2O7 |
650 | ~0,3 | 0,0010 | 0,057 |
|
UO4 . 2H2O |
800 | ~0,5 | 0,0002 | 0,019 |
Примечание. Восстановление проведено при постоянном парциальном давлении водорода 400 мм рт. ст.
С уменьшением среднего размера кристаллов закиси-окиси урана возрастает скорость восстановления; только лишь для очень тонкодисперсных материалов, для которых характерно спекание частиц при повышенных температурах, этот эффект несколько смазывается.
Для закиси-окиси урана, полученной при прокаливании триоксида урана в интервале температур 700 –800°С, реакция ее восстановления водородом имеет первый порядок и константа скорости реакции может быть вычислена по уравнению:
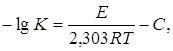
где К – константа скорости реакции, л/мин;
Е – энергия активации реакции, равная 34,2±2.3 ккал/моль;
R – газовая постоянная;
Т – абсолютная температура, К;
С – постоянная, равная 9,69±0,64.
Примеси оксидов металлов (Al2O3, Fe2O3, SiO2 и т. п.) уменьшают скорость восстановления закиси-окиси урана водородом. При восстановлении закиси окиси урана происходит некоторое измельчение порошка: полученный диоксид урана по размерам несколько меньше исходной закиси-окиси урана.
На основе рентгенографических данных установлено, что восстановление триоксида урана протекает в три основные стадии:
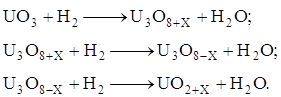
На первой стадии UO3 превращается в U3O8+X, имеющую ромбическую структуру и являющуюся верхним пределом области гомогенности U3O8. Вторая стадия протекает при гомогенном переходе от верхнего к нижнему пределу U3O8-X. На последней стадии происходит превращение в кубическую структуру UO2. Скорость восстановления на каждой из этих стадий различна и выражается своим кинетическим уравнением.
Для описания процесса восстановления оксидов урана водородом предложено несколько кинетических уравнений. Однако ни одно из них не является сколько-нибудь точным, так как процесс чрезвычайно сложен. В ходе него одна модификация вещества переходит в другую, изменяются природа и поверхность оксида и характер процесса.
Несмотря на значительные расхождения и даже противоречивость имеющихся экспериментальных данных, процесс восстановления триоксида урана можно описать общим уравнением, используемым обычно для расчета аппаратов. Например, восстановление триоксида урана, полученного прокаливанием уранилнитрита, описывается довольно простым уравнением:
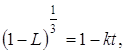
где L – степень превращения вещества;
К – постоянная, включающая константу скорости реакции;
T – продолжительность процесса.
Восстановление высших оксидов урана до диоксида может быть проведено также аммиаком. Технологическая целесообразность этого процесса обусловлена доступностью, взрывобезопасностью аммиака, а также удобством его транспортировки. Возможны два варианта процесса:
1. аммиак предварительно расщепляется и затем полученная азотно-водородная смесь подается на восстановление;
2. восстановление проводится непосредственно в токе аммиака.
Закономерности, рассмотренные для случая восстановления закиси-окиси и триоксида урана водородом, полностью сохраняются и для аммиака.
Аппаратурное оформление процессов
восстановления оксидов урана
Оборудование для восстановления оксидов урана постепенно совершенствовалось от самых примитивных до современных аппаратов. Вот краткий перечень основных аппаратов, в которых осуществляли процесс восстановления: лодочки, помещаемые в трубчатые неподвижные печи; вращающиеся барабанные печи с внешним подогревом; шнековые печи с наружным электронагревом; виброреакторы, где перемешивание и перемещение твердого материала производятся действием вибрации.
В настоящее время наиболее распространены аппараты кипящего слоя, высокопроизводительные и полностью автоматизированные. Применение этих аппаратов позволяет получать особо реакционноспособный диоксид урана, который на последующих стадиях может гидрофторироваться с малым избытком HF.
Преимущества аппаратов кипящего слоя видны из
сопоставления производительности реакторов различного типа (табл. 7), в которых
осуществляют процесс 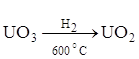 .
.
Таблица 7. Характеристика реакторов различного типа
| Реактор |
l, м |
d, м |
h, м |
V, м3 |
Производительность, кг/ч |
|
Шнековый Виброреактор Кипящего слоя из двух труб |
6,7 4,5 2,0 |
0,41 0,6 0,355 |
__ 0,152 __ |
0,84 0,44 0,49 |
90,6 136 – 227 250 – 540 |
Представляет практический интерес возможность получения диоксида урана из соли в результате одной операции, т. е. Совмещение прокаливания и восстановления. Это возможно для диураната аммония и аммонийуранилтрикарбоната вследствие диссоциации аммиака.
Требования к качеству диоксида урана
К качеству получаемого диоксида урана предъявляют строгие требования, особенно если он предназначается для непосредственного использования в ТВЭЛах. Необходимо принимать эффективные меры по исключению возможности загрязнения диоксида урана продуктами коррозии аппаратуры и другими случайными источниками.
Характерный состав примесей, присутствующих в порошке диоксида урана, полученном из диураната аммония и предназначенном для использования в ядерных реакторах в качестве материала ТВЭЛов, приведен в таблице 8.
Таблица 8. Примеси в порошке диоксида урана,
используемом в качестве материалов ТВЭЛов
| Элемент |
Содержание примеси, млн-1 |
| Бор | 0,2 |
| Медь | 10 |
| Железо | 60 |
| Никель | 70 |
| Кремний | 50 |
| Свинец | 2 |
| Олово | 1 |
| Хром | 30 |
| Фтор | 100 – 300 |
ЛИТЕРАТУРА
1. Громов Б.В. Введение в химическую технологию урана. М.: Атомиздат, 1978. С. 228 – 240.
2. Несмеянов А.Н. Радиохимия. М.; Химия, 1978. С. 285 – 286, 290 – 299, 300.
3. Шевченко В.Б., Судариков Б.Н. Технология урана. М.; Госатомиздат, 1961. С. 243 – 258.


