 Реферат: Растворы и растворимость
Реферат: Растворы и растворимость
Если полученные в опытах значения нанести на оси координат, то получаются так называемые кривые растворимости различных веществ (рис. 7-3). Эти кривые имеют практическое значение. По ним легко узнать, сколько вещества (например, KNO3) выпадет в осадок при охлаждении до 20 С насыщенного раствора, приготовленного при 80 С.
| . Вещество | Температура, ° C | ||||
| 0 | 20 | 50 | 80 | 100 | |
| KBr | 53,5 | 65,2 | 80,8 | 94,6 | 103,3 |
| NaCl | 35,7 | 35,9 | 36,8 | 38,1 | 39,4 |
|
CaSO4 |
0,176 | 0,206 | 0,180 | 0,102 | 0,066 |
Таблица 7-3. Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды
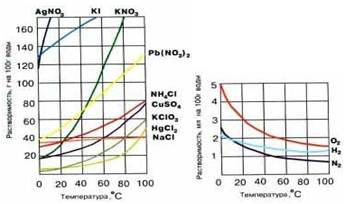
Рис. 7-3. Кривые растворимости твердых (а) и газообразных (б) веществ.
С помощью таких операций очищают вещества. Дело в том, что при охлаждении ненасыщенного раствора образуется насыщенный раствор, но насыщенный по основному веществу, которого больше всего, а не по примесям. Поэтому при охлаждении в осадок выпадает только чистое вещество, а примеси (вместе с частью вещества) остаются в растворе.
Чистые кристаллы отфильтровывают от охлажденного, загрязненного примесями раствора. Этот способ очистки называется ПЕРЕКРИСТАЛЛИЗАЦИЕЙ. Так очищают, например, многие лекарственные препараты.
Предельная растворимость многих веществ в воде (или в других растворителях) представляет собой постоянную величину, соответствующую концентрации насыщенного раствора при данной температуре. Она является качественной характеристикой растворимости и приводится в справочниках в граммах на 100 г растворителя (при определённых условиях).
Растворимость зависит от природы растворяемого вещества и растворителя, температуры и давления.
Природа растворяемого вещества. Кристаллические вещества подразделяются на:
P - хорошо растворимые (более 1,0 г на 100 г воды);
M - малорастворимые (0,1 г - 1,0 г на 100 г воды);
Н - нерастворимые (менее 0,1 г на 100 г воды).
(Смотри таблицу растворимости)
Природа растворителя. При образовании раствора связи между частицами каждого из компонентов заменяются связями между частицами разных компонентов. Чтобы новые связи могли образоваться, компоненты раствора должны иметь однотипные связи, т.е. быть одной природы. Поэтому ионные вещества растворяются в полярных растворителях и плохо в неполярных, а молекулярные вещества - наоборот.
Влияние температуры. Если растворение вещества является экзотермическим процессом, то с повышением температуры его растворимость уменьшается (Например,Ca(OH)2 в воде) и наоборот. Для большинства солей характерно увеличение растворимости при нагревании.
Практически все газы растворяются с выделением тепла. Растворимость газов в жидкостях с повышением температуры уменьшается, а с понижением увеличивается.
Влияние давления. С повышением давления растворимость газов в жидкостях увеличивается, а с понижением уменьшается.
КОНЦЕНТРАЦИЯ РАСТВОРОВ
Способы выражения концентрации растворов
Существуют различные способы выражения состава раствора. Наиболее часто используют массовую долю растворённого вещества, молярную и нормальную концентрацию.
Массовая доля растворённого вещества w(B) - это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора m :
w(B)= m(B) / m
Молярная концентрация C(B) показывает, сколько моль растворённого вещества содержится в 1 литре раствора.
C(B) = n(B) / V = m(B) / (M(B) • V),
где М(B) - молярная масса растворенного вещества г/моль.
Концентрацию раствора можно выразить количеством молей растворённого вещества в 1000 г растворителя. Такое выражение концентрации называют моляльностью раствора.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в одном литре раствора или число миллиграмм-эквивалентов в одном миллилитре раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Эоснования = Моснования / число
замещаемых в реакции гидроксильных групп
Экислоты = Мкислоты / число
замещаемых в реакции атомов водорода
Эсоли = Мсоли / произведение
числа катионов на его заряд
Величины нормальности обозначают буквой "Н". Например, децинормальный раствор серной кислоты обозначают "0,1 Н раствор H2SO4". Так как нормальность может быть определена только для данной реакции, то в разных реакциях величина нормальности одного и того же раствора может оказаться неодинаковой. Так, одномолярный раствор H2SO4 будет однонормальным, когда он предназначается для реакции со щёлочью с образованием гидросульфата NaHSO4, и двухнормальным в реакции с образованием Na2SO4.
Пересчет концентраций растворов из одних единиц в другие
При пересчете процентной концентрации в молярную и наоборот, необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора. Если мы обозначим: с - процентная концентрация; M - молярная концентрация; N - нормальная концентрация; э - эквивалентная масса, - плотность раствора; m - мольная масса, то формулы для пересчета из процентной концентрации будут следующими:
M = (c • p • 10) / m
N = (c • p • 10) / э
Этими же формулами можно воспользоваться, если нужно пересчитать нормальную или молярную концентрацию на процентную.
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот. Если эквивалентная масса вещества равна мольной массе (Например, для HCl, KCl, KOH), то нормальная концентрация равна молярной концентрации. Так, 1 н. раствор соляной кислоты будет одновременно 1 M раствором. Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую можно использовать формулы:
M = (N • Э) / m
N = (M • m) / Э
Растворимость твердых веществ |
Растворимость веществ, являющихся твердыми при температуре растворения, выражена через массовый коэффициент растворимости k (в граммах безводного вещества на 100 г воды). Как правило, растворимость приведена в холодной (20 °С) и горячей воде (80 С), иная температура указана верхним индексом, причем значок * отвечает интервалу комнатной температуры (18-25° С). Прочерк отвечает полному разложению вещества водой. Многоточие означает отсутствие данных.
|
Вещество |
k, 20° |
k, 80° |
Вещество |
k, 20° |
k, 80° |
| AgF | 172 | 216 |
KNO2 |
306,7 | 376 |
|
AgNO3 |
227,9 | 635,3 |
KNO3 |
31,6 | 168,8 |
|
AlCl3 |
45,9 | 48,6 | KOH | 112,4 | 162,5 |
|
Al2(SO4)3 |
36,4 | 73,1 |
K3PO4 |
98,5 |
178,560 |
|
B(OH)3 |
4,87 | 23,54 |
K2SO3 |
107,0 | 111,5 |
|
BaCl2 |
36,2 | 52,2 |
K2SO4 |
11,1 | 21,4 |
|
Ba(OH)2 |
3,89 | 101,4 |
K2S2O6(O2) |
4,7 |
11,040 |
| BaS | 7,86 | 49,91 | LiCl |
84,525 |
112,3 |
|
BeCl2 |
72,8 |
77,030 |
LiOH | 12,8 | 15,3 |
|
BeSO4 |
39,1 | 67,2 |
Li2SO4 |
34,7 |
31,975 |
|
CaCN2 |
2,5025 |
- |
MgCl2 |
54,8 | 65,8 |
|
CaCl2 |
74,5 | 147,0 |
MgSO4 |
35,1 | 54,8 |
|
Ca(ClO)2 |
33,325 |
- |
MnCl2 |
73,9 | 112,7 |
|
Ca(NO3)2 |
129,3 | 358,7 |
MnSO4 |
62,9 | 45,6 |
|
CdCl2 |
113,4 | 140,4 |
(NH4)2CO3 |
10015 |
- |
|
CdSO4 |
76,4 | 67,2 |
NH4Cl |
37,2 | 65,6 |
|
CrCl3 |
34,925 |
- |
N2H5Cl |
17925 |
… |
|
Cr2(SO4)3 |
6425 |
… |
NH4F |
82,6 | 117,6 |
| CsCl | 186,5 | 250 |
NH4HCO3 |
21,7 | - |
| CsOH |
385,615 |
30330 |
NH4HS |
128,10 |
- |
|
CuCl2 |
72,7 | 96,1 |
NH4NCS |
170 | 431 |
|
CuSO4 |
20,5 | 55,5 |
NH4NO3 |
192,0 | 580,0 |
|
FeCl2 |
68 | 90,7 |
(NH3OH)Cl |
83 | 194 |
|
FeCl3 |
91,9 | - |
(NH4)2SO4 |
75,4 | 94,1 |
|
Fe(NH4)2(SO4)2 |
26,4 |
5270 |
Na2B4O7 |
2,5 | 24,3 |
|
FeSO4 |
26,6 | 43,7 |
Na2CO3 |
21,8 | 45,1 |
|
Fe2(SO4)3 |
440* | - | NaCl | 35,.9 | 38,1 |
|
H2C2O4 |
9,52 | 84,5 | NaClO | 53,4 |
129,950 |
|
H2(PHO3) |
69430 |
… |
NaClO2 |
64 |
12260 |
|
H3PO4 |
548 | … |
NaClO3 |
95,9 |
203,9100 |
|
H2SeO4 |
566,6 |
275350 |
NaClO4 |
21125 |
30075 |
|
H6TeO6 |
50,0530 |
106,4 |
NaHCO3 |
9,59 | 20,2 |
| HgCl | 6,59 | 24,2 |
NaH2PO4 |
85,2 | 207,3 |
|
K[Ag(CN)2] |
25 | 100 |
Na2HPO4 |
7,660 |
92,4 |
|
KAl(SO4)2 |
5,9 | 71,0 |
NaHSO4 |
28,6 |
50100 |
|
K[Au(CN)2] |
14* | 200 |
NaNO2 |
82,9 | 135,5 |
| KBr | 65,2 | 94,6 |
NaNO3 |
87,6 | 149 |
|
KBrO3 |
6,87 | 34,28 | NaOH | 108,7 | 314 |
| KCN | 69,9 | 99,8 |
Na(PH2O2) |
8325 |
554100 |
|
K2CO3 |
111,0 | 139,2 |
Na2(PHO3) |
4190 |
… |
| KCl | 34,4 | 51,1 |
Na3PO4 |
14,525 |
68,0 |
|
KClO3 |
7,3 | 37,6 |
Na2S |
18,6 | 49,2 |
|
K2CrO4 |
63,0 | 75,1 |
Na2SO3 |
26,1 | 29,0 |
|
K2Cr2O7 |
12,48 | 73,01 |
Na2SO4 |
19,2 | 43,3 |
|
KCr(SO4)2 |
12,5125 |
… |
Na2(SO3S) |
70,1 | 229 |
| KF | 94,93 | 150,1 |
NiCl2 |
64,0 |
86,275 |
|
K3[Fe(CN)6] |
46,0 | 81,8 |
NiSO4 |
38,4 | 66,7 |
|
K4[Fe(CN)6] |
28,0 | 67,0 |
Pb(NO3)2 |
52,2 | 107,4 |
|
KHCO3 |
33,3 |
68,370 |
RbCl | 91,1 | 127,2 |
|
K(HF2) |
39,2 | 114 | RbOH |
17915 |
28247 |
|
KH2PO4 |
22,6 | 70,4 |
SnCl2 |
269,815 |
- |
|
K2HPO4 |
159,8 |
267,563 |
SnSO4 |
18,819 |
- |
| KI | 144,5 | 190,7 |
SrCl2 |
53,1 | 93,1 |
|
KIO3 |
8,1 | 24,8 |
TlNO3 |
9,55 | 111 |
|
KMnO4 |
6,36 |
2565 |
TlOH |
34,318 |
126,190 |
| KCN | 69,9 | 99,8 |
ZnCl2 |
367 | 549 |
| KNCS | 217 |
40867 |
ZnSO4 |
54,1 | 67,2 |


