Реферат: Молекулярно кинетическая теория
Реферат: Молекулярно кинетическая теория
Реферат: Молекулярно кинетическая теория
ОГЛАВЛЕНИЕ
1) Основные положения молекулярно-кинетической теории, ее опытные обоснования 2
2) Размеры молекул.............................................................................................................. 6
3) Микро- и макропараметры системы.............................................................................. 7
4) Основные уравнения молекулярно-кинетической теории идеального газа для давления 9
5) Скорости газовых молекул........................................................................................... 12 ......................................................................................................................................................
6) Энергия поступательного движения молекул газа.................................................... 13
7) Уравнение состояния идеального газа - уравнение Менделеева-Клапейрона....... 14
8) Опытные газовые законы. Давление смеси идеальных газов (закон Дальтона).... 15
1.Основные положения молекулярно-кинетической теории, ее опытные обоснования.
Согласно молекулярно-кинетической теории все вещества состоят из мельчайших частиц - молекул. Молекулы находятся в непрерывном движении и взаимодействуют между собой. Молекула - наименьшая частица вещества, обладающая его химическими свойствами. Молекулы состоят из более простых частиц - атомов химически элементов. Молекулы различных веществ имеют различный атомный состав.
Молекулы обладают кинетической энергией Wкин и одновременно потенциальной энергией взаимодействия Wпот. В газообразном состоянии Wкин > Wпот. В жидком и твердом состояниях кинетическая энергия частиц сравнима с энергией их взаимодействия (Wкин Wпот).
Поясним три основных положения молекулярно - кинетической теории.
1. Все вещества состоят из молекул, т.е. имеют дискретное строение, молекулы разделены промежутками.
2. Молекулы находятся в непрерывном беспорядочном (хаотическом) движении.
3. Между молекулами тела существуют силы взаимодействия.
Молекулярно-кинетическая теория обосновывается многочисленными опытами и огромным количеством физических явлений.
Существование молекул блестяще подтверждается законом кратных отношений. Он гласит: "при образовании из двух элементов различных соединений (веществ) массы одного из элементов в разных соединениях относятся как целые числа, т.е. находятся в кратных отношениях". Например, азот и кислород дают пять соединений: N2O, N2O2, N2O3, N2O4, N2O5. В них с одним и тем же количеством азота кислород вступает в соединение в количествах, находящихся между собой в кратных отношениях 1:2:3:4:5. Закон кратных отношений легко объяснить. Всякое вещество состоит из одинаковых молекул, имеющих соответствующий атомный состав. Так как все молекулы данного вещества одинаковы, то отношение весовых количеств простых элементов, входящих в состав всего тела, такое же, как и в отдельной молекуле, и, значит, является кратным атомных весов, что и подтверждается опытом.
Наличие промежутков между молекулами следует, например из опытов смещения различных жидкостей: объем смеси всегда меньше суммы объемов смешанных жидкостей.
Приведем некоторые из доказательств беспорядочного (хаотического) движения молекул:
а) стремление газа занять весь предоставленный ему объем (распространение пахучего газа по всему помещению);
б) броуновское движение - беспорядочное движение мельчайших видимых в микроскоп частиц вещества, находящихся во взвешенном состоянии и нерастворимых в ней. Это движение происходит под действием беспорядочных ударов молекул, окружающей жидкости, находящихся в постоянном хаотическом движении;
в) диффузия - взаимное проникновение молекул соприкасающихся веществ. При диффузии молекулы одного тела, находясь в непрерывном движении, проникают в промежутки между молекулами другого соприкасающегося с ним тела и распространяются между ними. Диффузия проявляется во всех телах - в газах, жидкостях и твердых телах, - но в разной степени.
Диффузию в газах можно наблюдать если сосуд с пахучим газом открыть в помещении. Через некоторое время газ распространится по всему помещению.
Диффузия в жидкостях происходит значительно медленнее, чем в газах. Например, в стакан нальем раствор медного купороса, а затем, очень осторожно добавим слой воды и оставим стакан в помещении с постоянной температурой и где он не подвергается сотрясениям. Через некоторое время будем наблюдать исчезновение резкой границы между купоросом и водой, а через несколько дней жидкости перемешаются, несмотря на то, что плотность купороса больше плотности воды. Так же диффундирует вода со спиртом и прочие жидкости.
Диффузия в твердых телах происходит еще медленнее, чем в жикостях (от нескольких часов до нескольких лет). Она может наблюдаться только в хорошо пришлифованных телах когда расстояния между поверхностями пришлифованных тел близки к расстояниям между молекулами (10-8 см). При этом скорость диффузии увеличивается при повышении температуры и давления.
Разновидностью диффузии является ОСМОС - проникновение жидкостей и растворов через пористую перегородку. Диффузия и осмос играют большую роль в природе и технике. В природе благодаря диффузии осуществляется питание растений из почвы. Организм человека и животных всасывает через стенки пищеварительного тракта питательные вещества. В технике с помощью диффузии поверхностный слой металлических изделий насыщается углеродом (цементация).
Доказательства силового взаимодействия молекул:
а) деформация тел под влиянием силового воздействия;
б) сохранение формы твердыми телами;
в) поверхностное натяжение жидкостей и, как следствие, явление смачивания и капиллярности.
Между молекулами существуют одновременно силы притяжения и силы отталкивания (рис. 1). При малых расстояниях между молекулами преобладают силы отталкивания. По мере увеличения расстояния r между молекулами как силы притяжения, так и силы отталкивания убывают, причем силы отталкивания убывают быстрее. Поэтому при некотором значении r0 (расстояние между молекулами) силы притяжения и силы отталкивания взаимно уравновешиваются.
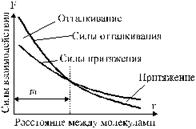
Рис. 1
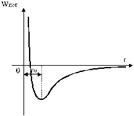
| Если условиться отталкивающим силам приписывать положительный знак, а силам притяжения - отрицательный и произвести алгебраическое сложение сил отталкивания и притяжения, то получаем график, изображенный на рис. 2. |
Рис.
2 Рис. 3 |
На рис. 3 дан график зависимости потенциальной энергии взаимодействия молекул от расстояния между ними. Расстояние r0 между молекулами соответствует минимуму их потенциальной энергии (рис. 3). Для изменения расстояния между молекулами в ту или другую сторону требуется затратить работу против преобладающих сил притяжения или отталкивания. На меньших расстояниях (рис. 2) кривая круто поднимается вверх; эта область соответствует сильному отталкиванию молекул (обусловленному главным образом кулоновским отталкиванием сближающихся ядер). На больших расстояниях молекулы притягиваются. Расстояние r0 соответствует устойчивому равновесному взаимному положению молекул. Из рис. 2 видно, что при увеличении расстояния между молекулами, преобладающие силы притяжения восстанавливают равновесное положение, а при уменьшении расстояние между ними равновесие восстанавливается преобладающими силами отталкивания.
Современные экспериментальные методы физики (рентгеноструктурный анализ, наблюдения с помощью электронного микроскопа и др.) позволили наблюдать микроструктуру веществ.
2.Размеры молекул
Число граммов вещества,
равное молекулярному весу этого вещества, называется грамм-молекулой или
молем. Например, 2 г водорода составляет грамм-молекулу водорода; 32 г
кислорода составляют грамм-молекулу кислорода. Масса одного моля вещества
называется молярной массой этого вещества. Обозначается через m. Для водорода![]() ; для кислорода
; для кислорода ![]() ; для азота
; для азота![]() и т.д.
и т.д.
Число молекул, содержащихся в одном моле разных веществ одинаково и называется числом Авогадро (NA).
![]()
Число Авогадро чрезвычайно велико. Чтобы почувствовать его колоссальность, представьте себе, что в Черное море высыпали число булавочных головок (диаметр каждой около 1 мм), равное числу Авогадро. При этом оказалось бы, что в Черном море уже не остается места для воды: оно не только до краев, но и большим избытком оказалось бы заполненным этими булавочными головками. Авогадровым числом булавочных головок можно было бы засыпать площадь, равную, например, территории Франции, слоем толщиной около 1 км. И такое огромное число отдельных молекул содержится всего лишь в 18 г воды; в 2 г водорода и т.д.