 Статья: Взаимосвязь основных внутриколониальных процессов при ветвлении у колониальных гидроидов
Статья: Взаимосвязь основных внутриколониальных процессов при ветвлении у колониальных гидроидов
Статья: Взаимосвязь основных внутриколониальных процессов при ветвлении у колониальных гидроидов
А. А. Леонтович, Н. Н. Марфенин
Колониальные гидроиды стали удачной моделью для изучения механизмов интеграции примитивных биосистем организменного уровня. В процессе роста форма, размеры и число компонентов колонии все время меняются, но остаются оптимальными для данных условий существования. Это достигается с помощью регуляции потребления питательного материала при линейном росте, ветвлении и увеличении объема тела, связанных друг с другом определенной последовательностью смены процессов.
Особенности морфологии и физиологии гидроидных полипов делают их одними из наиболее удачных объектов для исследования закономерностей взаимосвязи отдельных морфогенетических актов с единым процессом формообразования целостной, хорошо интегрированной живой системы — колонии гидроидов.
Все части колонии морфологически и по происхождению являются единым телом с общей гастроваскулярной полостью, через которую осуществляется транспорт пищи, продуктов обмена веществ и, возможно, клеток на значительные расстояния. Таким образом, взаимосвязь основных внутриколониальных процессов (пищеварения, пролиферации, роста, редукции частей колонии, ветвления) осуществляется через гидроплазму—жидкость, заполняющую полость колонии. Несмотря на примитивность распределительной системы, ее функционирование обеспечивает достаточно эффективную физиологическую интеграцию колонии в единый организм (Карлсен, Марфенин, 1984; Марфенин, 1985, 1986). Это проявляется в поддержании в процессе роста колонии определенных соотношений между количествами разнотипных составляющих. Нарушение количественных пропорций вызывает такие изменения в росте, которые приводят к восстановлению утраченных соотношений (Марфенин, 1977; Stebbing. 198I).
В настоящее время уже получены данные о характере зависимости роста колонии от интенсивности питания (Bravennan, 197I, 1974; Марфенин, Бурыкин, 1979; Бурыкин, 1980; Марфенин, 1987), о степени автономности ростовых пульсаций верхушек столонов и побегов (Косевич, 1988).
Назрела необходимость ответить на вопрос: от каких факторов зависит ветвление колоний, играющее ведущую роль в обеспечении их оптимального строения и роста? Решая эту задачу, мы использовали оправдавший себя ранее метод анализа морфологии объекта при разных режимах его кормления (Марфенин, 1986) и удобный модельный объект — стелющиеся колонии гидроида Cordylophora inkermanica (Marfenin, 1983).
Материал и методы
С. inkermanica — представитель примитивных колоний стелющегося типа из сем. Clavidae, подотряда Athecata, отряда Leptolida. У этих гидроидов побеги короткие и ветвятся слабо, поэтому зооиды отходят обычно непосредственно от столонов. Материал собран в Севастопольской бухте Черного моря; гидроидов культивировали в лаборатории. Морфология и биология вида описаны ранее (Марфенин, 1983, 1985). Проведены три серии экспериментов: первая и вторая—на Беломорской биостанции МГУ в 1984 и 1987 гг., третья—на кафедре зоологии беспозвоночных биологического факультета МГУ в 1984 г. В первых двух сериях животных содержали в 5-литровом кристаллизаторе, воду в котором меняли один раз в два дня. В третьей серии опытов гидроиды находились в 40-литровом аквариуме с беломорской водой (соленость 28°/оо). Осуществлялась постоянная аэрация и фильтрация воды через отдельный грунтовый фильтр. Воду не меняли 4 мес. Температура содержания в первой серии была 14±2°С, во второй 15±2°С и в третьей 14±1°С.
Колонии выращивали на стеклах по методике Кроуэлла (Crowell,, 1957) из отрезков столона длиной 1,5—4,5 мм, в каждом из которых было по одному гидранту. Гидрант и отрезок мы называем “начальными”, а столон, являющийся продолжением начального отрезка,— “центральным” или “главным” столоном. На центральном столоне в результате его ветвления образуются боковые столоны (рис. 1, 2).
Эксперимент проводили в первые 8—14 сут роста начального отрезка. Каждый гидрант колонии кормили индивидуально из пипетки. Кормом служили свежевылупившиеся науплиусы Artemia sp. Среднесуточное количество корма, полученное каждой колонией, было пропорционально ее размеру, который выражали суммарной длиной гидроризы в миллиметрах. Удельные количества пищи значительно различались в колониях, что позволяло сравнивать эффект кормления. Ежедневно проводили картирование колоний по известной методике (Марфенин, 1980). Всего был изучен рост 66 колоний. Для определения объемных параметров роста в 14 из них проведено измерение диаметров перисарка, ценосарка и гастральной полости. Измерения проводили in vivo в проходящем свете под микроскопом с точностью до 4 мкм через каждые 0,5 мм по длине столона. Таким образом, число промеров было пропорционально размерам колоний. В малых колониях (с длиной гидроризы 8—9 мм) сделано по 14—18, а в больших (длиной 80—100 мм) по 150—200 промеров. По результатам измерений вычислены значения толщины стенок ценосарка столонов, что дало возможность определить объем ткани в них.
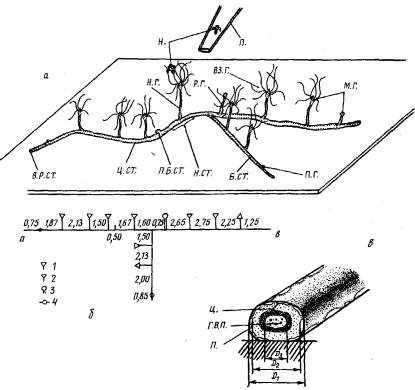
Рис.1. a — общий вид небольшой колонии, выращенной на пластине из оргстекла. Н. СТ.—начальный столон; Н. Г.—начальный гидрант; Ц, СТ.—центральный столона Б. СТ.— боковой столон; П. Б. СТ.— почка бокового столона; В. Р. ОТ.— верхушка роста столона; П. Г.— почка гидранта; М. Г.— молодой гидрант; ВЗ. Г.— взрослый гидрант; Р. Г.— редуцирующийся гидрант; Н — науплиус Artemia sp.; П.— кончик пипетки; б—карта-схема этой же колонии. Цифры—расстояние между структурами, мм:
1—взрослый гидрант; 3—молодой гидрант; 3—редуцирующийся гидрант; 4—почка гидранта; в — схема поперечного среза столона. Промеры диаметров: D1 — перисарка (П.); D2.—ценосарка (II.); D3—гастроваскулярной полости (Г. В. П.)
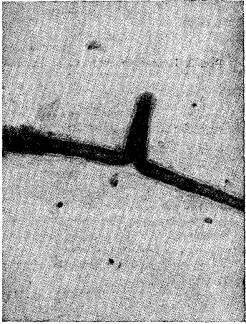
Рис. 2. Фотография бокового столона через 12 ч после его образования
РЕЗУЛЬТАТЫ
Поскольку колонии существенно различны по размерам, то абсолютное число науплиусов (F1), полученное каждой из них в течение эксперимента, не может служить показателем интенсивности питания.
Универсальной характеристикой размера колонии является длина гидроризы (L). Остальные параметры — число верхушек роста столонов (В), число гидрантов—редуцирующихся (Hd), формирующихся (Нi2) и взрослых, сформированных (H),—пропорционально L.
Поэтому интенсивность питания мы определяли удельным среднесуточным количеством пищи F/Lt; (науплиусов/(мм-сут), где t—период времени, сут, который прошел со времени выделения начального отрезка до того, как проводили измерения. Интенсивность питания в разных колониях была различна—от 0,03 до 0,49 науплиусов/(мм-сут).
Динамика роста существенно различалась в колониях, получавших различное количество пищи. Для характеристики морфологии и динамики роста колоний мы использовали следующие показатели.
1. Скорость роста верхушек столона (l/В) отражает величину средней скорости роста любого столона в колонии. Для его вычисления значение суточного прироста всей колонии делили на общее число верхушек ее столонов.
2. Вероятность образования новых столонов в колонии (Р) вычисляли делением числа колоний, в которых при заданных условиях кормления образовался хотя бы один столон, на общее число колоний, содержащихся при таких же условиях. Вероятность выражали в процентах.
3. Разветвленность гидроризы (B—2/L) показывает, сколько боковых столонов приходится на единицу длины гидроризы колонии. Для вычисления этого параметра число верхушек столонов без двух делили на суммарную длину столонов колонии. В неразветвленной колонии, которая состоит из одного столона с двумя верхушками (В =2), этот показатель принимает нулевое значение.
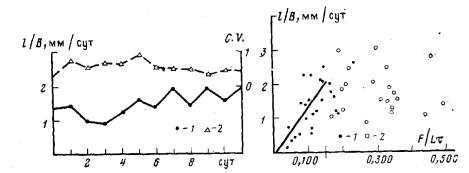
Рис. 3 . . Рис. 4
Рис. 3. Изменение скорости роста столона (/) и коэффициента вариации (С. V.} (2) с течением времени (сут). Каждая точка соответствует среднему значению для выборки из 10 колоний
Рис. 4. Зависимость средней скорости роста верхушки столона {l/B) от интенсивности питания колонии (F/Lt). 1—значения для неветвящихся колоний; 2—значения накануне ветвления колонии. Прямая определяется уравнением l/B = 0,Ol5 F/lt —0,095, коэффициенты которого вычислены по методу наименьших квадратов для интервала 0 < F/Lt £ O,150. Распределение экспериментальных точек на указанном интервале достоверно соответствует уравнению прямой (коэффициент корреляции С. V. = 0,0664).
4. Удельное число гидрантов, на рост которых расходуется питательный материал (Hg2/L=Hi2—Hd /L.). В литературе имеются указания на то, что клеточный материал, освобождающийся при рассасывании гидрантов, может переноситься гидроплазмой в другие части колонии и использоваться там для их роста (Nathanson, 1955; Hale, 1964; Braverman, 1974). Поэтому мы предположили, что количество питательного материала, поступающего в колонию в результате дедифференцировки одного старого гидранта, примерно эквивалентно тому количеству материала, которое расходуется на рост одного нового.
Для вычисления введенного показателя разность между числом гидрантов, находящихся в процессе формирования (такими мы считали растущие гидранты, у которых было менее шести щупалец), и числом дегенерирующих делили на суммарную длину гидроризы колонии.
5. Объем ткани единицы длины ценосарка (v/L) вычисляли, измеряя диаметр ценосарка и гастроваскулярной полости, и затем по соответствующей формуле—площадь сечения стенки ценосарка в данном месте столона. Сделав большое количество замеров в колонии, вычисляли среднюю площадь, сечения ценосарка в ней. Объем ткани единицы длины ценосарка имеет то же численное значение и ту же размерность (мм), что и площадь сечения.
Измерение скоростей роста столонов в 10 колониях, получивших примерно одинаковое небольшое количество пищи,—0,126 (С. V.=0,191) науплиусов/(мм×сут), показало, что в первые 6 сут после выделения из материнской колонии рост столона еще не стабилизирован (рис. 3). В этот период изменение скорости роста носит нерегулярный характер и вариабельность средних ее значений в разных колониях непостоянна в течение времени, но, начиная с 7-х сут, стабилизируется. По этой причине мы рассматривали лишь те морфологические показатели, которые относились к периоду стабилизированного роста колоний — с 7-х по 14-е сут.
Когда интенсивность питания не превышает величины 0,200 науплиусов/(мм×сут), средняя скорость роста столона тем выше, чем больше среднее количество пищи, полученное колонией (рис. 4). Распределение экспериментальных точек достоверно соответствует уравнению линейной регрессии l/B = 0,015F/t - 0,095 (г-0,664; n - 36), вычисленному по методу наименьших квадратов. При более интенсивном питании ускорения роста не происходит. В этих условиях уже в большинстве колоний (более 55%) образуются новые столоны, за счет которых об щий прирост гидроризы продолжает увеличиваться (рис. 5), несмотря на то, что скорость роста каждого отдельного столона больше не возрастает.
На характер ветвления столонов влияют количество пищи и динамика поступления ее в колонию. Кормление проводили двумя разными способами. В одной группе (33 колонии) удельное среднесуточное количество пищи было в каждой колонии довольно постоянно. Средний коэффициент вариации показателя интенсивности питания (F/Lt) для 23 колоний (n =23) составил 0,37. В другой группе (33 колонии) каждая колония сначала получала ежедневно одно и то же небольшое количество пищи (F/Lt=0,137; C.V.=0,55) и новых столонов в них не образовывалось. На 7—14-е сут роста каждая колония получала одноразовую избыточную дозу корма (F/L = 0,434; С. V. = 0,32), так что среднее значение показателя F/Lt изменялось в среднем на 0,038 науплиусов/(мм×сут) (C.V.=0,57). Такое “импульсное” кормление приводило к образованию боковых столонов. Условия ветвления столонов в первой и второй группах колоний несколько отличались.
В первой группе вероятность образования почки столона (Р) возрастает с увеличением интенсивности питания (рис. 6, а). При интенсивности питания менее 0,100 науплиусов/(мм×сут) новых столонов не образуется. Далее при увеличении количества пищи от 0,100 до 0,250 науплиусов/(мм×сут) вероятность образования столонов увеличивается и при интенсивности питания 0,250 и выше составляет 100%. Среднее число образующихся почек столонов почти не зависит от интенсивности питания и составляет 3,5—4 почки на колонию (рис. 6, б). Однако показатель разветвленности гидроризы B—2/L при этом все же несколько увеличивается (рис. 6, в). Это связано с тем, что при обильном кормлении ветвление в колонии начинается раньше, когда длина гидроризы еще невелика (рис.6,г). При более умеренном питании ветвление начинается на 2-3 дня позже, когда размер колонии несколько больше.
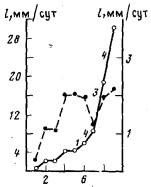
Рис. 5. Изменение суточного прироста гидроризы (l) (сплошная линия) и средней скорости роста верхушек столонов (1/В) (пунктирная линия) с течением времени. Цифры рядом с отрезками сплошной линии означают число почек столонов, образовавшихся за сутки
Импульсное кормление вызывает более или менее значительное увеличение средней интенсивности питания, в среднем на 0,038 науплиусов/(мм×сут) (С.V.=0,56; n=30). Оказалось, что ни вероятность ветвления гидроризы, ни число образующихся столонов практически не зависят от величины интенсивности питания, возросшей в результате импульсного кормления (рис. 6, д, е). Вероятность ветвления возрастает от 70 до 80% при увеличении показателя F/Lt от 0,100 до 0,250 науплиусов/(мм×сут). Среднее число образующихся столонов при этом возрастает от 3,15 до 3,30 экз/колонию. Такое изменение не является достоверным (t=0,200; п=28). Почки столонов появляются через 26±2 ч после импульсного кормления.
В тех колониях, которые получали мало пищи (менее 0,100 науплиусов/(мм×сут), формирующихся гидрантов было меньше, чем рассасывающихся. В этих случаях показатель Hg/L принимает, отрицательные значения (рис. 7). При увеличении интенсивности питания величина этого показателя возрастает, причем какого-либо предельного его значения в наших экспериментах обнаружено не было. Среднее значение параметра Hg/L (0,123) достоверно выше (t=2,227; n=24) в тех колониях, где не образовалось ни одного бокового столона, и ниже (Hg/L=0,056) в тех, которые ветвятся.
С увеличением удельного среднесуточного количества пищи возрастает средняя площадь сечения трубки ценосарка столона (рис. 8). Зависимость площади сечения перисарка от питания имеет аналогичный характер. В среднем площадь сечения ценосарка в экспериментальных колониях составил 2,83×10-3 мм3. Минимальное значение, которое было зарегистрировано,—1,82×10-3, а максимальное — 4,43×10-3 мм3. Разность объемов ткани ценосарка двух колоний одинаковой длины (L=20 мм), в одной из которых интенсивность питания была 0,050 науплиусов/(мм×сут), а в другой 0,380 науплиусов/(мм×сут), составила 1,2×10-2 мм3. Эта величина соответствует объему ценосарка столона длиной 4 мм, т. е. трехдневному приросту одной верхушки столона при обильном питании (0,300 науплиусов/(мм×сут). Расчеты показали, что если удельное среднесуточное количество пищи в одной колонии на 0,400 науплиусов/(мм×сут) больше), чем в другой, то общие объемы тканей ценосарков этих колоний должны различаться в 2 раза. Кроме того, подсчитано, что возрастание интенсивности питания на 0,050 пауплиусов/(мм×сут) вызывает увеличение объема ткани, эквивалентное объему ценосарка столона длиной 0,6 мм. Скорость роста столона при таком изменении интенсивности питания увеличивается на 1 мм/сут.
При недостаточном питании (менее 0,100 науплиусов/(мм×сут)) в колонии происходит редукция столонов и гидрантов. Ценосарк при этом уменьшается в толщине — “худеет” и столон укорачивается с концов. Число редуцирующихся гидрантов в таких колониях превосходит число растущих. На приведенных графиках этой ситуации соответствуют отрицательные значения показателей 1/В, В—2/L и HgfL (рис. 4, 6, 7).
).
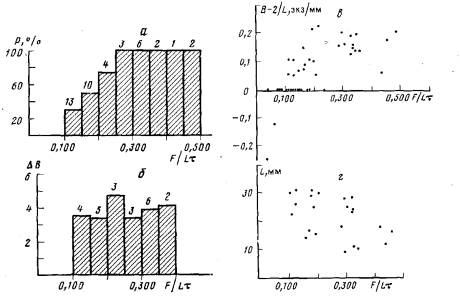
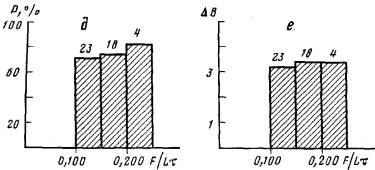
Рис. 6. Влияние литания на ветвление гидроризы колонии. Цифры над гистограммами указывают объем выборок, а—зависимость вероятности образования почек боковых столонов (Р) от интенсивности питания (F/Lr) при равномерном кормлении; б—зависимость числа почек боковых столонов (В) от интенсивности питания (F/Lt) при равномерном кормлении; в — изменение показателя раэветвленности гидроризы (В — 2/L) в зависимости от интенсивности питания {F/Lt} при равномерном кормлении; г — значения интенсивности питания н размера колонии (L), при котором произошло ветвление в колониях при равномерном кормлении; д—зависимость вероятности образования почек боковых столонов (Р) от интенсивности питания {F/Lt} при импульсном кормлении; е—зависимость числа почек боковых столонов (6) от интенсивности питания {F/Lt} при импульсном кормлении
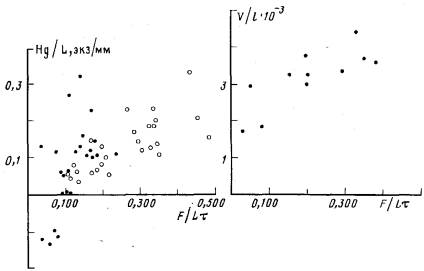
Рис. 7. Зависимость удельного числа гидрантов, на рост которых расходуется пища (Hg/L), от интенсивности питания(F/Lt)
Рис, 8. Зависимость удельного объема ткани ценосарка столона (V/L) от интенсивности питания {F/Lt)
Обсуждение результатов
Изучение закономерностей ветвления в колонии гидроидных полипов имеет большое значение для выяснения регуляторных механизмов поддержания такой структуры колонии, которая наилучшим образом соответствовала бы условиям ее существования, и прежде всего трофической емкости среды. Ранее было показано (Марфенин, 1977), что в колонии гидроидов в процессе ее роста сохраняется определенная пропорция между числом гидрантов, числом верхушек роста столонов и длиной гидроризы. Это способствует наиболее эффективному усвоению пищи, в результате которого обеспечивается быстрый рост колонии. Было установлено, что соответствие между ростом и его трофическим обеспечением осуществляется посредством четырех основных механизмов.
1. Изменение скорости роста столонов в определенном диапазоне в зависимости от интенсивности питания было зарегистрировано Ю. Б. Бурыкиным (1980) на колониальном гидроиде Dynamena pumila L. В дальнейшем эта зависимость была подтверждена на другом Obelia loveni Allm. (Марфенин, 1987). При увеличении скорости роста столонов происходит не только удлинение их тела, но и увеличение числа новообразованных гидрантов или побегов, каждый из которых также растет, а следовательно, потребляет клеточный материал. Поэтому возможность изменения в некоторых пределах скорости роста столонов позволяет нелинейно менять интенсивность потребления в колонии клеточного материала.
2. Изменение доли растущих побегов и столонов было впервые обнаружено Н. Н. Марфениным (1977) также при изучении D. pumila. Практически всегда в колонии растут не все имеющиеся верхушки роста. Доля растущих от общего числа имеющихся в наличии может существенно меняться — при недостатке пищи часть верхушек побегов и столонов прекращает расти, а при избытке пищи часть нерастущих верхушек возобновляет свой рост.
3. Ткани редуцирующихся гидрантов служат дополнительным источником пищи. Лангер (Lunger, 1963) называет ее “вторичной пищей”. С помощью оптической, а затем и электронной микроскопии было показано, что клетки дедифференцирующихся гидрантов попадают в гастроваскулярную полость побегов (Huxley, De Beer, 1923) и гидроризы (Полтева и др., 1987). Затем энтодермальные клетки гидроризы фагоцитируют и переваривают частицы вторичной пищи (Lunger, 1963). Таким образом, существуют как бы два типа источников пищи для колонии. Первый — внешняя среда, пищевые ресурсы которой потенциально не ограничены; второй — дедифференцирующиеся части самой колонии. Количество питательного материала, поступающего из этого источника, ограничено объемом тканей редуцирующихся частей колонии.
4. Образование новых зон роста или ветвление колонии происходит как в процессе обычного роста столонов (новые гидранты), так и при избытке пищи (Марфенин, Бурыкин, 1979; Бурыкин, 1980). Ветвление не сдерживается какими-либо рамками и может привести к почти неограниченному увеличению числа новых зон роста. Поэтому этот способ регуляции роста колонии был признан наиболее радикальным (Марфенин, 1977).
Если образование очередных побегов или гидрантов (в случае стелющейся колонии) происходит регулярно по мере роста столонов примерно на равных расстояниях друг от друга, то образование боковых столонов выглядит неупорядоченно: ни место, ни число новых столонов не бывают точно определены. Однако всякий раз, когда происходит ветвление, оно приводит к нормализации количественного баланса между различными компонентами колонии—нормализации, имеющей большое экологическое значение” так как в результате достигается соответствие между ростом колонии и трофическими возможностями среды.
Полученные данные позволяют представить, как работает этот механизм. Образование новых зон роста—ветвление столонов—связано не только с интенсивностью питания колонии, но и со скоростями роста имеющихся верхушек, толщиной трубки ценосарка, количеством растущих гидрантов и интенсивностью редуцирования старых гидрантов.
Все эти внутриколониальные процессы взаимосвязаны через потребление питательного материала.
Из рис. 4, 6, 8 следует, что при возрастании интенсивности питания происходят увеличение скорости роста столонов, активизация ветвления, увеличение удельного числа формирующихся гидрантов и утолщение ценосарка. Следует обратить внимание на то, что увеличение скорости роста столонов и, видимо, утолщение ценосарка происходят лишь до определенных пределов. Сравнение данных по различным колониям позволяет выявить определенную иерархию (или очередность) процессов,
Полученная колонией пища расходуется на утолщение ценосарка. Механизм этого процесса пока не вполне ясен. Это может быть увеличение числа клеток в результате их деления или увеличение объема клеток без деления. Кроме того, питательный материал расходуется на рост столонов в длину и на образование новых гидрантов. Баланс между поступлением пищи в колонию и потреблением ее на рост колонии может быть как положительным, так и отрицательным. Если баланс положительный, то обеспечивается ускорение роста столонов. То, что это происходит при меньших значениях интенсивности питания, чем ветвление столонов (до 0,150 науплиусов/(мм×сут)), свидетельствует о приоритетности данного процесса над ветвлением. Одновременно с обеспечением роста столонов в длину пища расходуется на утолщение столона и рост гидрантов. Первый из этих процессов почти в 2 раза менее эффективен, чем расходование пищи на рост столонов. Второй складывается из двух компонентов—образования новых гидрантов и рассасывания старых. Число почек гидрантов непосредственно зависит от скорости роста столонов, поскольку почки образуются на одинаковом расстоянии друг от друга. Число же рассасывающихся гидрантов не зависит от скорости роста, а зависит от размеров колонии и интенсивности питания. При той интенсивности, при которой происходит ветвление столонов (более 0,150 науплиусов/(мм×сут)), удельное число таких гидрантов очень мало (0,03—0,05 экз/мм, т. е. один на колонию). Таким образом, для регуляции скорости потребления пищи в колонии первостепенное значение имеет рост столонов в длину. Изменение толщины стенок ценосарка и числа растущих гидрантов также влияет на скорость использования пищи в колонии, но имеет второстепенное значение.
Результаты экспериментов с импульсным кормлением также соответствуют описанной схеме процесса ветвления столонов. При выбранной фоновой интенсивности питания (0,137 науплиусов/(мм×сут)) скорость поступления пищи а колонию уравновешена скоростью ее расходования на удлинение столонов, связанное с ним образование новых гидрантов, а также на утолщение ценосарка. Добавление большой одноразовой дозы корма (0,434 науплиусов/(мм×сут)) приводит к тому, что скорости этих процессов достигают предельных значений и остается еще избыток питательного материала, что и приводит к образованию новых зон его потребления — почек столонов. После своего формирования верхушка роста столона становится активным потребителем питательного материала, воздействуя на породивший ее столон уже по принципу обратной связи.
В итоге мы приходим к заключению, что питание различным образом влияет на образование и рост разных частей колонии. Это влияние имеет упорядоченный характер и является основой внутриколониальных процессов регуляции структуры колонии. Важную роль в этих процессах играет конкуренция между зонами роста за питательный материал. Однако конкретный механизм конкурентных взаимодействий между зонами пока не ясен и его предстоит изучить.
Список литературы
Бурыкин Ю. Б. Регулирующая роль некоторых экологических факторов в процессах роста и интеграции колониальных гидроид о в//Теоретическое и практическое значение кишечнополостных. Л.: ЗИН АН СССР, 1980. С. 16—19.
Карлсен А. Г., Марфенин Н. Н. Перемещение гидроплазмы в колонии у гидроидов на примере Dynamena pumila (L.) и некоторых других видов//Журн. общ. биологии. 1984. Т. 45. № 5. С. 670—680.
Косевич И. А. Взаимодействие локальных и общеколониальных процессов в росте колонии Obella loveni (AIlm.) (Hydrozoa, Campanulariidae): Автореф. дис. ... канд. биол. наук. М.: МГУ, 1988. 16 с.
Марфенин Н. Н. Опыт изучения интеграции колонии гидроида Dynamena pumila (L.) с помощью количественных морфологических показателей//Журн. общ. биологии. 1977. Т. 38. №3. С. 409—422.
Марфенин Н. Н. Метод картирования пространственной организации колониальных Hydrozoa и его значение при изучении частей колонии//Теоретическое и практическое значение кишечнополостных. Л,: ЗИН АН СССР, 1980. С. 66—69.
Марфенин. Н. Н. Новый вид Gordylophora (Hydrozoa, Clavidae) из Черного моря//3оол. журн. 1983. Т. 62. Вып. 11. С. 1732—1734.
Марфенин Н. Н. Морфофункциональный анализ стелющейся колонии у гидроидов на примере Cardylophora inkermanica Marfenin (Athecata, ClavidaeV/Æóðí. общ. биологии. 1985. Т. 46. № 4. С. 541—555.
Марфенин Н Н Колониальная организация у гидроидов. Автореф. дисс. ... докт. биол. наук. Л.: ЗИН АН СССР, 1986. 49 с.
Марфенин Н Н Рост колоний гидроида ОЬеПа loveni в зависимости от количества пищи/Тез, докл. III съезда океанологов. Л.: ЗИН АН СССР, 1987. С. 128—130.
Марфенин Н. Н., Бурыкин Ю. Б. Зависимость роста колонии Dynamena pumila (L.) (Hydrozoa, Sertulariidae) от количества получаемой пищи//Вестн. МГУ. Сер. 16. Биология. 1979. № 1. С. 61—68.
Полтева Д. Г., Донаков В. В., Айзенштадт Т. Б. Сезонные изменения клеточного состава в колонии гипогенетического гидроида Obelia 1оует//3оол. журп. 1987. Т. 66.Вып. 8. С. 1135—1147.
Braverman М. H. Studies on hydroid differentiation. VII. The hydrozoan stolon//J. Morphol. 1971. V. 135. № 2. Р. 131—152.
Braverman M. H. The cellular basis for colony form in Podocoryne carnea//Amer. Zool.1974. V. 14. № 2. Р. 673—698.
Crowell S. Differential responses of growth zones to nutritive level, age, and temperature in the colonial hydroid Campanularia//J. Exper. Zool. 1957, V. 134. P. 63—90.
Hale L. J. Cell movements, cell division and growth in the hydroid Clytia johnstoni//J.Embryol. Exp. Morphol. 1964. V. 12.№ 2. Р. 517—538.
Huxley J. S. Beer G. R. de. Studies in dedifferentiation. IV. Resorption and differential inhibition in Obelia and Campanularia//Q. J. Microsc. Set. 1923. V. 67. P. 473—495.
Lunger Ph. D. Fine structural aspects of digestion in a colonial hydroid//J. Ultrastruct. Res. 1963. V. 9. № 3—4. Р. 362—380.
Naihanson D. L. The relationship of regenerative ability to the regression of hydrants of Campanularia//Biol. Bull. 1955. V. 109. № 3. Р. 350.
Stebbing A..R. D. The kinetics of growth control in a colonial hydroid//J. Mar. Biol. Assoc. U. K. 1981. V. 61. № 1. Р. 35—63.
Для подготовки данной работы были использованы материалы с сайта http://soil.msu.ru/


