 Реферат: Сравнительная характеристика методов лабораторной диагностики трихомоноза
Реферат: Сравнительная характеристика методов лабораторной диагностики трихомоноза
1.4.4 Методы генной диагностики T.vaginalis
С начала 90-х годов в лабораторную клиническую практику стали, внедрятся технологии определения видоспецифических нуклеотидных последовательностей областей ДНК (мишеней) бактерий и клеток высших организмов. Сначала это была ДНК-гибридизационная технология. В тест-системе Affirm VP используются синтетические зонды для выявления как Gardnerella vaginalis, так и T.vaginalis из одного вагинального соскоба. Данная методика лучше, чем метод влажной камеры. Тем не менее, встречались ложноотрицательные результаты при её сравнении с культуральным методом (80% чувствительности относительно положительных образцов в культуре). Одна из гибридизационных методик - “дот-блот” гибридизация, в которой использовался фрагмент 2,3 ДНК T.vaginalis в качестве зонда, могла определить ДНК T.vaginalis в вагинальном секрете. Однако нестабильность зонда, выполнение специфических технических приёмов, особенно использование радиоактивной метки, являлись большими недостатками этой методики. После того как радиоактивно меченный зонд заменили на флюоресцентно-меченный ДНК-зонд, эта методика сразу нашла своё применение при выявлении бессимптомного носительства T. vaginalis. Новая генодиагностическая технология - ПЦР, в последнее время опережает остальные методы генодиагностики трихомоноза и наравне с культуральным методом широко используется в клинической практике. Риу в 1999 г. предложили ПЦР методику идентификации ДНК влагалищной трихомонады с праймерами для амплификации повторяющегося фрагмента TV-E650. Сравнив свой метод с другими используемыми методиками диагностики: микроскопией нативного мазка, культуральным, а также с клиническими данными. Он считает, что предложенный метод ПЦР на 100% чувствителен и специфичен, т.к. не давал перекрёстной реакции с другими простейшими и Candida albicans. Использованная им методика ПЦР в два раза чаще выявляла трихомонаду, чем другие лабораторные методики. Японские учённые так же сумели подтвердить правомерность постановки диагноза “трихомониаз” в 19-ти случаях у женщин и в одном случае у мужчины методом ПЦР[43,44,45,46,48].
1.5. Лечение трихомоноза
Препарат выбора - метронидазол, или его аналог. Препарат назначают внутрь, внутривенно или внутривагинально. Эффективность химиотерапии достигает 80-95%. В последнее время чаще рекомендуется применять комплексную терапию, с использованием новейших препаратов, к примеру, таких, как Наксоджин. Кроме этого советуют проводить местную обработку слабыми дезинфекторами и растворами, снимающими воспаление. Причина данной терапии обусловлена адаптационными механизмами трихомонад. В силу чего сегодня редкий врач владеет методикой эффективного лечения этой патологии [1,2,18,25].
2.МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЙ
Все исследования по теме квалификационной работы проводились на базе Одесского областного кожно-венерологического диспансера, расположенного по адресу: г. Одесса, ул. Воробьева, 5.
В исследовании, которое проходило в период с декабря 2003 года по май 2004 года, принимали участие исключительно мужчины в количестве 150 человек. Пациенты были обследованы на трихомоноз тремя методами: культуральным, микроскопии окрашенного мазка и ПЦР.
Всем обследуемым, за сутки до взятия материала производилась внутримышечная инъекция пирогенала, в дозе – 50 МПД, согласно инструкции приведенной [18]. Вследствие чего на момент анализа у 60% больных отмечались слизистые, слизисто – гнойные выделения.
2.1. Исследование культуральным методом.
Культуральный метод исследования заключался в посевах патологического материала (отделяемого уретры) на ИПС, по методике [21]. Использовалась питательная среда для выделения влагалищных трихомонад (Э).
Следующего состава, г/л:
ферментолизат биомассы микроорганизмов без оболочек
(осветлённый) 14,2
мальтоза 8,0
хлорид натрия 6,0
хлорид калия 0,1
карбонат натрия 1,2
РН среды доводился до 6,0 ± 0,2.
Препарат разработан ЦКВИ, выпускается НПО “ Питательные среды“.
Материал выделений и соскоб забираются ложечкой Фолькмана, если выделения обильные, то можно использовать бактериологическую петлю, при этом для увеличения отделяемого, левой рукой производится массаж уретры выжимающими приёмами (дистально-проксимальное направление). При посеве ложечка Фолькмана с посевным материалом опускается в среду до дна пробирки и энергично круговыми движениями смывается. Пробирка у спиртовки закрывается ватно-марлевой пробкой и ставится на инкубацию при 37 градусах Цельсия.
Учёт результатов проводился путём микроскопического исследования препаратов через 7 дней после посева. Осадок отбирался пастеровской пипеткой и микроскопировался в тёмном поле с увеличением 280. При положительном результате наблюдались движущиеся паразиты: одиночные или в скоплениях. Все препараты смотрелись нативными.
2.2. Исследование методом микроскопии мазка.
Метод микроскопии мазка основан на анализе соскоба или выделений, с последующей их окраской, методика[39]. Соскоб берется желобоватым зондом или тупой ложечкой из уретры. Из ложечки биологический материал извлекался копьём для перфорации кожного покрова. Выделения брались мазком – отпечатком.
Стекла обрабатывались так же, как и посуда, бывшая в употреблении, мылись и кипятились 15 минут в 0,5% мыльном растворе, затем многократно ополаскивались в горячей воде и не менее 5 раз в дистиллированной. После этого сушились в сухожаровом шкафу. Далее натирались между двумя дощечками с прикреплённой тканью и помещались до опыта в смесь спирта с эфиром 1:1. (Чистота стёкол в подобной диагностике имеет важное значение!)
Отобранный материал эмульгировался (очень нежно) на предметном стекле, после чего высушивался на воздухе 20-30 минут, затем окрашивался – 1% раствором метиленового синего, в течении 3 минут. В положительных случаях, обнаруживались трихомонады различной формы. Не больше одной в поле зрения.
Ядро окрашивалось в темно – синий, а протоплазма – в бледно-синий цвет. Трихомонады имели: овальную, круглую и грушевидную формы. Препарат смотрелся при увеличении 630 с иммерсионным объективом.
2.3 Исследование методом ПЦР
Для ПЦР – диагностики использовались соскобы уретры.
Все анализы на основе этого метода по группам больных проводились сотрудниками кафедры Кожных и венерических болезней Одесского Государственного Медицинского Университета.
Результаты обследованных были любезно предоставлены {XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX}! Простите этого человека не указываю!
3.РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
В ходе проведения собственных исследований по сравнению различных методов диагностики трихомоноза у мужчин, общее количество которых составляло 150 человек, были получены следующие результаты: наиболее удачным методом диагностики трихомоноза является метод микроскопии окрашенного мазка. Его информативность составила 71%. За ним следует метод ПЦР, (включающий в себя данные исследований по различным группам), он составил 26%. И наименее информативным, а, следовательно, менее надежным методом диагностики трихомоноза, оказался культуральный метод. Его информативность составила 3%. Полученные результаты отражены на рисунке 1.
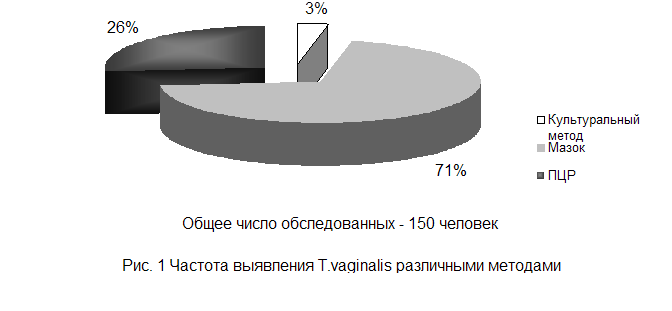
Исходя из результатов исследований можно сделать следующие выводы: для экспресс – диагностики мочеполового трихомоноза наиболее удобно использовать метод микроскопии окрашенного препарата уретрального соскоба или окрашенного мазка выделений. Более надёжный результат будет при проведении предварительной провокации пирогеналом. В случае непереносимости препарата (больные с острыми лихорадочными заболеваниями, беременные, гипертоники, диабетики), его можно заменить определенной комбинацией продуктов раздражающих слизистую оболочку желудка.
Данный метод имеет, перед остальными способами диагностики, ряд преимуществ: относительно недорогой и простой в проведении, результат достигается по истечении короткого промежутка времени, не требует применения дорогого лабораторного оборудования и высокой квалификации персонала.
В отношении метода ПЦР – диагностики трихомоноза, можно отметить следующее: по своей информативности он сегодня ещё уступает методу микроскопии окрашенного мазка. Это обусловлено недостаточной степенью очистки ДНК – возбудителя от балластных компонентов биоптата. Весомым недостатком ПЦР метода являются, сложность постановки опыта, необходимость применения дорогого оборудования и высокая стоимость анализа.
В настоящее время метод ПЦР диагностики T.vaginalis ещё недостаточно отработан. Такой вывод можно сделать на основании данных предоставленных сотрудниками кафедры Кожных и венерических болезней ОГМУ.
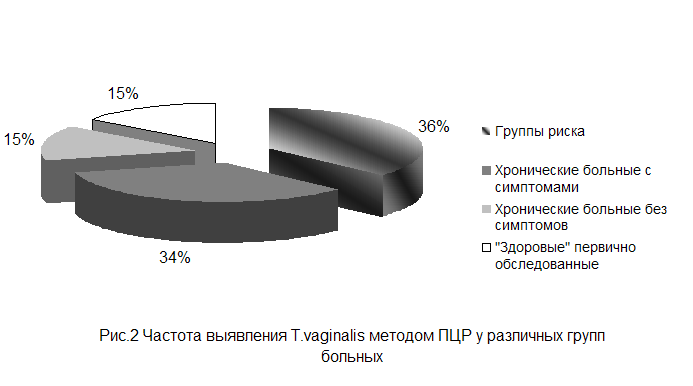 Метод ПЦР подтвердил наличие трихомонад у больных отнесённых
к группе риска на 36%. У хронических больных с характерными симптомами этот
показатель составил 34%, хронические больные без симптоматики и «здоровые»
первично обследуемые, дали по-15% подтверждения. Данная информация отражена на
рисунке 2.
Метод ПЦР подтвердил наличие трихомонад у больных отнесённых
к группе риска на 36%. У хронических больных с характерными симптомами этот
показатель составил 34%, хронические больные без симптоматики и «здоровые»
первично обследуемые, дали по-15% подтверждения. Данная информация отражена на
рисунке 2.


