 Реферат: Получение синтетических красителей реакцией азосочетания на примере синтеза 3-окси-4-карбоксиазобензола
Реферат: Получение синтетических красителей реакцией азосочетания на примере синтеза 3-окси-4-карбоксиазобензола
В основе технологии получения азокрасителей лежат две химические реакции: 1) диазотирование ароматического амина, 2) сочетание полученного диазосоединения с амином или фенолом.
3.2. Реакция диазотирования
Диазотированием называют взаимодействие первичного ароматического амина с азотистой кислотой в присутствии избытка минеральной кислоты. Как правило, минеральная кислота берётся в некотором избытке (2,5 эквивалента на 1 эквивалент амина). При этом образуется диазосоединение.
Азотистая кислота неустойчива и легко разлагается, поэтому при диазотировании применяют не свободную азотистую кислоту, а её соль – нитрит натрия. Эта соль при действии на неё минеральной кислоты (обычно соляной, реже – серной) образует азотистую кислоту, которая вступает в реакцию с амином. Поэтому часть минеральной кислоты, взятой для реакции, расходуется на разложение нитрита натрия с образованием азотистой кислоты: NaNO2 + HCl → HNO2 + NaCl.
Схему реакции диазотирования, в присутствии соляной кислоты, можно представить в общем виде:
![]()
Диазосоединения в этой форме называются соли диазония. Само диазосоединение является катионом [ArN2]+, а остаток кислоты – анионом. Например, при диазотировании анилина получают хлористый фенилдиазоний (I), при диазотировании n-нитроанилина – хлористый n-нитрофенилдиазоний (II) и.т.д.; при диазотировании в присутствии серной кислоты образуются соответствующие сернокислые соли (III, IV):
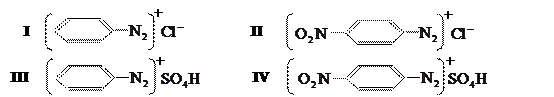

Большинство ароматических диазосоединений весьма неустойчиво. В твёрдом состоянии они разлагаются при нагревании, при ударе, причём иногда со взрывом. В растворах при низких температурах они сравнительно устойчивы, но при нагревании водных растворов разложение происходит довольно быстро. Поэтому диазотирование ведут при низкой температуре, а растворы диазосоединений, как правило, не хранят, а сразу же пускают в дальнейшую переработку. Особенно неустойчивы диазосоединения, полученные при диазотировании анилина и его гомологов (толуидина, ксилидонов и др.) Поэтому диазотирование их ведут при температуре от 0 до 5˚С. Значительно более устойчивы диазосоединения из изомерных нитроанилинов, хлоранилинов, амино-бензойных кислот, т.е. ароматических аминов, содержащих так называемые отрицательные заместители. Их диазотируют при более высокой температуре (до 20˚С). Амины диазотируются тем легче, чем выше их основность. Когда основность амина сильно понижена вследствие наличия в ядре заместителей II рода, как, например, в п-нитроанилина, диазотирование следует производить в более концентрированных растворах сильных кислот.
Диазотирование ведут, как было указано, в кислой среде, чаще всего в среде соляной кислоты. В серной кислоте диазотирование идёт медленнее, чем в соляной. Так как солянокислые соли большинства ароматических аминов лучше растворяются в воде, чем сернокислые и, кроме того, отличается каталитическое действие ионов галогена. Добавка бромистого натрия (или другого бромида) значительно ускоряет реакцию.
Диазотирование обычно ведут в присутствии значительного избытка кислоты. Это необходимо, чтобы предотвратить побочные реакции, приводящие к снижению выхода основного продукта. Соли диазония химически очень активны и в ходе реакции диазотирования могут вступать в реакцию с исходным аминосоединением, образуя диазоаминосоединения: [ArN2]+Cl- + ArNH2 → Ar─N══N─HN─Ar. В сильнокислой среде эта реакция практически не идёт. Кроме того, в присутствии большого избытка минеральной кислоты повышается стойкость раствора диазосоединения.
Если ароматический амин нерастворим в водном растворе кислоты (как, например, сульфаниловая кислота или n-нитроанилин), то применяют различные приёмы, чтобы перевести его в раствор или в мелкодисперсную форму, удобную для диазотирования. Для этого, например, сульфаниловую кислоту растворяют в растворе аммиака или соды, а затем добавляют в кислоту; при подокислении амин выпадает в осадок в мелкораздробленной форме. Аминосоединения, находящиеся в растворе, обычно диазотируются быстрее, причём скорость диазотирования возрастает с увеличением концентрации в растворе аминосоединения. Аминосоединения, труднорастворимые в кислоте, диазотируются медленнее. При диазотировании таких аминосоединений, находящихся в форме суспензии, скорость диазотирования связана с размером частиц: чем мельче частицы суспензии, тем быстрее диазотируется аминосоединение.
В зависимости от свойств исходного ароматического амина и получаемого диазосоединения диазотирование ведут по-разному.
Анилин и толуидин смешивают с водой, добавляют рассчитанное количество соляной кислоты и образовавшийся раствор солянокислой соли амина охлаждают при размешивании до 0-2˚С. Солянокислые соли анилина и его гомологов хорошо растворимы в воде и при охлаждении не выпадают в осадок. К охлаждённому раствору постепенно приливают раствор нитрита натрия. Температура реакционной массы при диазотировании не должна превышать 5˚С. Диазосоединение образуется в форме соли диазония C6H5N2Cl.
Диамины, т.е. соединения с двумя аминогруппами, по-разному ведут себя в реакции диазотирования. м-Диамины, например м-фенилдиамин, легко диазотируются с образованием бисдиазосоединения:
![]()
![]()
|
|
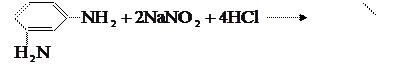

Образовавшееся бисдиазосоединение легко вступает в реакцию сочетания с исходным м-фенилдиамином; при этом образуется краситель. Диазотирование n-диаминов осложняется их склонностью к окислению, которое особенно легко протекает в среде концентрированной серной кислоты. Поэтому красители на основе бисдиазотированного n-фенилдиамина (т.е. дисазокрасители) получают не из n-фенилдиамина, а из n-нитроанилина или N-ацетил-n-фенилдиамина. n-Нитроанилин диазотируют, получают краситель на основе этого диазосоединения (моноазокраситель), а затем в полученном красителе восстанавливают нитрогруппу в аминогруппу, диазотируют её и переводят в дисазокраситель.
Бензидин и другие амины, в которых аминогруппы расположены в разных
ароматических ядрах, диазотируются обычными приёмами в обеих аминогруппах: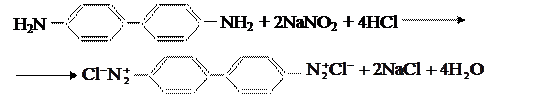

При диазотировании контролируют температуру, кислотность среды и наличие в реакционной массе азотистой кислоты.
Кислотность контролируют при помощи индикаторной бумаги конго, которая в присутствии соляной или серной кислоты изменяет свой красный цвет на синий. Присутствие значительного избытка кислоты – важнейшее условие проведения реакции диазотирования. При недостатке кислоты снижается условие проведения реакции диазотирования. При недостатке кислоты снижается устойчивость диазосоединения и возникают побочные реакции, приводящие к загрязнению диазосоединения.
Наличие азотистой кислоты определяют при помощи индикаторной йодкрахмальной бумаги. Она представляет собой фильтровальную бумагу, пропитанную раствором йодистого калия и крахмала и высушенную. На йодкрахмальную бумагу наносят каплю реакционной массы. При наличии азотистой кислоты на белой полоске бумаги образуется синее пятно, но только в том случае, если раствор содержит избыток минеральной кислоты. Поэтому сначала следует проверить кислотность среды по бумаге конго, а затем – наличие азотистой кислоты по йодкрахмальной бумаге.
3.3. Реакция азосочетания
Азосочетанием называется взаимодействие диазосоединений с ароматическими аминами и фенолами (нафтолами); оно приводит к образованию азокрасителей.
В реакции азосочетания участвуют два реагента: диазосоединение (обычно в форме соли диазония) и ароматический амин или фенол (нафтол). Амин, из которого получено диазосоединение, называют диазосотавляющей реакции азосочетания, а второй реагент – азосоставляющей (не путать с азосоединением!). Например, при получении красителя хризоидина сочетанием диазотированного анилина с м-фенилдиамином:
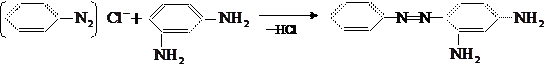

диазосоставляющей является анилин, а азосоставляющей – м-фенилдиамин.
В качестве азосоставляющей используют ароматические соединения, содержащие гидроксильную группу OH, аминогруппу NH2, а также замещённую аминогруппу NHAlk, N(Alk)2, NHAr.. Активной формой диазосоставляющей является катион диазония [ArN2]+.


