 Реферат: Гемоглобин эритроцитарных мембран человека
Реферат: Гемоглобин эритроцитарных мембран человека
В зависимости от электрофоретической подвижности белки были разделены на 15 фракций, 16-ю составил гемоглобин. При электрофорезе белковые фракции расположились по мере уменьшения молекулярных масс белков. Из таблицы 1 видно, что наиболее представительными белками в мембранах эритроцитов человека являются анионтранспортный белок полосы 3, a- и b-спектрины и актин. Второе место по количественному содержанию заняли белки полосы 4.5 (транспортер глюкозы и нуклеозидов), белки полосы 7 (основным белком этой полосы является тропомиозин) и белок полосы 4.2 (паллидин).
Менее представительными оказались анкирины 2.1, 2.2, и 2.3, белок полосы 4.1, глицеральдегид-3-фосфатдегидрогеназа и глутатион-S-трансфераза. Наименьшим содержанием отличался белок полосы 4.9 и мембрансвязанный гемоглобин. Количественное содержание гемоглобина составило 17,40±0,74 мкг на 1 мг общего белка мембран. Кроме того, гемоглобину соответствовало и наименьшее значение дисперсии (d2= 66,91).
Проведенное исследование количественного содержания основных белков мембран эритроцитов позволило оценить их представительность. Полученные нами показатели согласуются с литературными данными. [4, 5]
Взаимное варьирование количественной представительности отдельных белков эритроцитов человека.
С целью установления особенностей взаимного варьирования содержания белковых фракций в анализируемых образцах нами был проведен многомерный количественного содержания белков эритроцитарных мембран человека. Была построена матрица фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов. Данная матрица представлена в таблице 2. Из нее видно, что полученные коэффициенты корреляции имели как положительную, так и отрицательную направленность.
Для установления приоритетности во взаимосвязях вариабельности количественного содержания гемоглобина и основных мембранных белков эритроцитов нами был проведен кластерный анализ. Полученные результаты представлены на рисунке 6.
Кластерный анализ корреляционной матрицы позволил выделить 4 группы взаимнокоррелирующих белков по их количественному содержанию. Первую группу составили a- и b-спектрины, белки полосы 4.1, 4.2 (r=0,255). В состав второй группы вошли анкирины 2.1, 2.2 и 2.3 (r=0,278). Третью группу образовали гемоглобин, тропомиозин, глютатион-S-трансфераза и белок полосы 4.5.1 (r=0,316). Четвертую группу составили актин, белки полосы 4.5, глицеральдегид-3-фосфатдегидрогеназа и анионтранспортный белок полосы 3 (r=0,209). Исключение составила фракция 4.9, вариабельность количественного содержания которой носила независимый характер.
Низкий уровень объединения наблюдался между количественным содержанием анкирином 2.3 и анкирином 2.1 и 2.2 (r=0,278), актином и белком полосы 4.5 (r=0,327).
Рисунок 6
Дендрограмма фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов человека
N = 124 R (5%) = 0,176
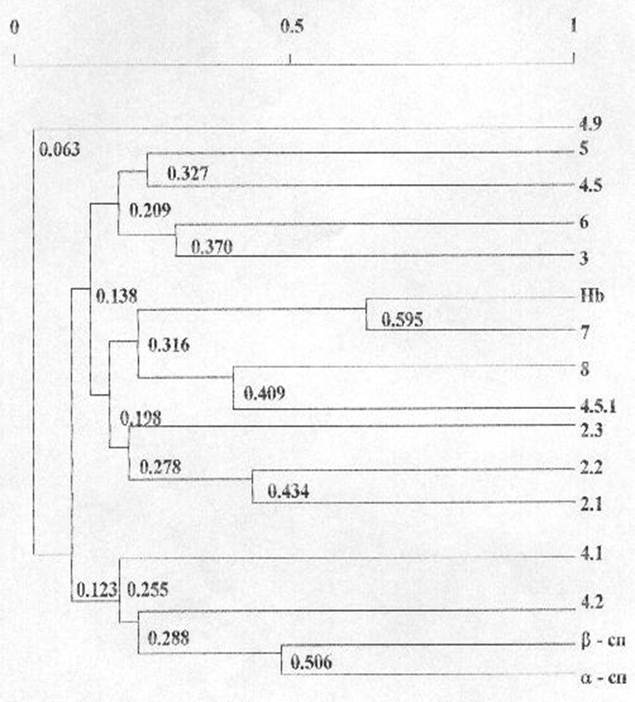
Группу кластеров со средним уровнем
объединения составили анкирины 2.1 и 2.2 (r=0,434),
глутатион-S-трансфераза и белок полосы 4.5.1 (r=0,409),
глицеральдегид-3-фосфатдегидрогеназа и белок полосы 3 (r=0,370).
Высокий уровень объединения имел место между количественным содержанием a- и b-спектринов (r=0,506)
Самый высокий уровень объединения (r=0,595) соответствовал количественному содержанию гемоглобина и белков полосы 7, основным составляющим белком которой является тропомиозин.
Обсуждение
На основе полученных данных установлено, что наиболее представительными белками в мембранах эритроцитов человека являются анионтранспортный белок полосы 3, a- и b-спектрины, а также актин. Наименьшее количественное содержание соответствует мембрансвязанному гемоглобину. Несмотря на то, что он содержится в мембране эритроцитов человека в меньшем количестве, гемоглобин играет важную роль как в образовании и поддержании стабильности цитоскелета, так и в механизмах ферментативного катализа и внутриклеточной трансформации энергии.
Полученные данные позволили предположить, что в эритроцитарных мембранах рассматриваемые белки во взаимном варьировании их количественного содержания образуют 4 группы взаимнокоррелирующих систем. Причем каждая из этих групп по отношению к остальным характеризуется относительной независимостью.
Согласно результатам нашего исследования количественное содержание гемоглобина наиболее тесно связано с содержанием тропомиозина. О причинах этого пока судить трудно вследствие недостаточного количества данных, касающихся этого вопроса - в доступной нам литературе он не получил должного освещения. Но мы надеемся, что полученные данные послужат основой для дальнейшей детализации в изучении связи гемоглобина со структурными белками.
Таким образом, полученные нами данные свидетельствуют о сложной структурной и функциональной взаимосвязи белков в мембранах эритроцитов.
заключениеЦитоплазматические мембраны эритоцитов человека играют ключевую роль в обеспечении и регуляции физиологической активности этих клеток. Специфические функции мембран обеспечивает сложная структурная организация, главным компонентом которой являются белки.
Современные биохимические и биофизические методы позволили выделить практически все основные мембранные белки эритроцитов, изучить их биохимическую структуру и основные аспекты функционирования. Вместе с тем в научной литературе не получил должного освещения вопрос о структуре мембрансвязанного гемоглобина, о его связи со структурными белками. Нами была проведена оценка количественного содержания гемоглобина и основных белков мембран эритроцитов человека, так как нормальное функционирование мембраны определяется не только присутствием белковых компонент, но и их количественным содержанием.
Кроме того был предпринят анализ взаимоварьирования количественного содержания гемоглобина и структурных белков. В ходе исследования нами был установлен факт взаимозависимости количественного содержания гемоглобина и тропомиозина. Результаты данного исследования могут служить основой для дальнейшей детализации в изучении связи гемоглобина со структурными белками. Нами планируется провести ряд исследований с целью изучения количественного содержания гемоглобина и его взаимосвязи со структурными белками мембран эритроцитов не только в норме, но и при различных патологических состояниях. С тем, чтобы прогнозировать наряду с уровнем данных нарушений их связь между собой и влияние на них изменений окружающей среды.
выводы
1. Количественное содержание гемоглобина в мембранах эритроцитов составляет 17,40±0,74 мкг на 1 мг общего белка мембран и является наименьшим, по сравнению с количественным содержанием остальных мембранных белков.
2. Вариабельность количественного содержания гемоглобина характеризуется достаточно высокой сопряженностью с количе37ственным содержанием белка полосы 7 – тропомиозина.
Литература
1. Балашов В.И., Резаев А.А., Ярыга В.В. Содержание гемоглобина и его дериватов в крови детей, проживающих в населенных пунктах санитарно-защитной зоны астраханского газового комплекса// Педиатрия. – 1995. - №2. – С.75-77.
2. Блюменфельд Л.А. Гемоглобин// Соросовский образовательный журнал. – 1998. - №4. – С.33-38.
3. Гааль Э., Медьеши Г., Верецки Л. Электрофорез в разделении биохимических макромолекул. – М. – 1982. – 446с.
4. Гончаренко М.С., Андрух Г.А., Рязанцев В.В. Белковый спектр эритроцитарных мембран в норме и при псориазе// Вестник дерматологии и венерологии. – 1989. - №3. – С.4-7.
5. Гончарова Е.И., Пинаев Г.П. Белки цитоскелета эритроцитов// Цитология. – 1988. – т.30, №1. – С.5-18.
6. Громов П.С., Захаров С.Ф., Шишин С.С., Ильинский Р.В. Двумерная карта мембранных белков эритроцитов человека// Биохимия. – 1988. – т.53, вып.8. – С.1316-1326.
7. Громов П.С., Шандала А.М., Ковалев Л.И., Шишкин С.С. Изучение белков мембран эритроцитов человека методом двумерного электрофореза// Бюллетень экспериментальной биологии и медицины. – 1986. - №7. – С.28-30.
8. Казеннов А.М., Маслова М.Н. Влияние мембранного скелета безъядерных эритроцитов на свойства транспортных АТФаз// Цитология. – 1991. – т.33, №11. – С.32-41.
9. Казеннов А.М., Маслова М.Н. Структурно-биохимические свойства мембраны безъядерных эритроцитов// Физиологический журнал СССР им. И.М.Сеченова. – 1987. – т.73, №12. – С.1587-1594.
10. Казеннов А.М., Маслова М.Н., Шагабодов А.Д. Роль белков мембранного скелета безъядерных эритроцитов в функционировании мембранных ферментов// Докл. АН СССР – 1990. – т.312. - №1. – С.223-226.
11. Лакин Г.Ф. Биометрия: Учебное пособие для биол. спец. Вузов – 4-е изд., перераб. и доп. – М.: Высш.шк., 1990. – 352с.
12. Остерман Л.А. Методы исследования белков и нуклеиновых кислот. Электрофорез и ультрацентрифугирование. – М.: Наука, 1981. – 288с.
13. Петренко Ю.М., Владимиров Ю.А. Роль поверхностных зарядов в поддержании осмотической резистентности эритроцитов// Гематология и трансфузиология. – 1987. - №10. – С.15-18.
14. Солодилова М.А. Роль генетических и средовых факторов в детерминации количественного содержания основных белков мембран эритроцитов человека/ Дис. на соискание ученой степени к.б.н. – М., 1999. – 160с.
15. Шандала А.М., Захаров С.Ф., Громов П.С., Шишкин С.С. Белковый состав мембран эритроцитов человека, фракционных в ступенчатом градиенте декстрана// Гематология и трансфузиология. – 1987. - №10. – С.28-31.


