 Реферат: Донозологический период эпилепсии у детей, основанная по данным докторской диссертации Миридонова В.Т.
Реферат: Донозологический период эпилепсии у детей, основанная по данным докторской диссертации Миридонова В.Т.
Реферат: Донозологический период эпилепсии у детей, основанная по данным докторской диссертации Миридонова В.Т.
В.Т. Миридонов
ДОНОЗОЛОГИЧЕСКИЙ ПЕРИОД ЭПИЛЕПСИИ У ДЕТЕЙ
Оглавление
| Введение. | 7 | ||
| 1.Актуальность проблемы и концепция донозологического периода эпилепсии у детей. | 7 |
||
| 2.Материал и методы исследования. | 10 | ||
| Глава 1. | Формирование эпилепсии у детей. | 16 | |
| 1.1. | Церебральные пароксизмы в детской неврологической клинике. | 16 |
|
| 1.2. | Донозологические проявления эпилепсии у детей по данным литературы. | 24 |
|
| 1.3. | Манифестные проявления эпилепсии у детей. Критерии диагностики заболевания. | 35 |
|
| Глава 2. | Клиническая картина и диагностика донозологического периода эпилепсии у детей. | 53 |
|
| 2.1. | Эпилептические припадки в донозологическом периоде эпилепсии у детей. | 53 |
|
| 2.2. | Неэпилептические пароксизмы в донозологическом периоде эпилепсии у детей. | 75 |
|
| 2.3. | Состояние психики в донозологическом периоде эпилепсии у детей. | 94 |
|
| 2.4. | Течение, исход и продолжительность донозологических проявлений эпилепсии у детей. | 98 |
|
| 2.5. | Факторы риска и основы прогнозирования эпилепсии у детей с церебральными пароксизмами. | 105 |
|
| Глава 3. | Патофизиология донозологических проявлений эпилепсии у детей. | 120 |
|
| 3.1. | Анализ результатов электроэнцефалографического исследования больных группы риска по эпилепсии. | 120 |
|
| 3.2. | Анализ результатов комплексного исследования больных группы риска по эпилепсии. | 136 |
|
| Глава 4. |
Медицинская тактика при церебральных пароксизмах у детей и лечение эпилепсии в донозологическом периоде заболевания |
147 |
|
| 4.1. | Основные положения рациональной медицинской тактики при первых церебральных пароксизмах у детей. | 147 |
|
| 4.2. | Лечение донозологических проявлений эпилепсии и методика диспансерного наблюдения при церебральных пароксизмах у детей. | 154 |
|
| Заключение | 163 | ||
| Список литературы | 175 | ||
Условные сокращения
| АРП | – аффективно-респираторные припадки |
| АЭП | – антиэпилептические препараты |
| ДПЭ | – донозологический период эпилепсии |
| ЛРК | – лимбико-ретикулярный комплекс |
| ЦП | – церебральные пароксизмы |
| ЭП | – эпилептические припадки |
| ЭЭГ | – электроэнцефалография, электроэнцефалограмма |
ВВЕДЕНИЕ
- Актуальность проблемы и концепция донозологического периода эпилепсии у детей.
По данным литературы, до 10% населения в популяции переносят церебральные пароксизмы (ЦП), причем большую часть заболевших составляют дети. Известно также, что до 8-летнего возраста около 5% детей переносят по крайней мере один эпилептический припадок [Гусев Е.С., Бурд Г.С., 1994] и 18% детей и подростков страдают парасомниями [Болдырев А.И., 1987].
Что касается собственно эпилепсии, то не смотря на многовековую историю развития учения об этом заболевании, все его основные разделы остаются еще несовершенными, находятся в стадии разработки, либо являются дискуссионными. Речь идет об этиологии и патогенезе эпилепсии, клинических проявлениях и классификации, критериях позитивной и дифференциальной диагностики, лечении и профилактике заболевания. В связи с этим, успехи современной эпилептологии еще не удовлетворяют мировое сообщество. Так например, лишь у 60% больных эпилепсией удается достигнуть контроля эпилептических припадков (ЭП), еще у 10-20% можно получить положительный результат с некоторыми побочными эффектами. Количество резистентных к лечению наблюдений достигает 40%, и около 20% детей больных эпилепсией становятся инвалидами и утрачивают обучаемость вследствие частых тяжелых припадков и выраженных нарушений психики [Искандер М.Б., 1993]. Более того, международный конгресс по эпилепсии 1995 г. констатировал, что за последние 30 лет заболеваемость, количество больных эпилепсией и количество резистентных к лечению наблюдений не снижаются, и это не смотря на внедрение в практику более десятка новых мощных антиэпилептических препаратов (АЭП) и современную технологию их применения, допускающую назначение субтоксических доз препарата в надежде получить ремиссию по припадкам или стабилизацию процесса. Конгресс выразил сомнение в необходимости синтеза новых АЭП и с его трибун прозвучал очередной призыв к поиску новых направлений в борьбе с эпилепсией.
Одно из таких новых направлений мы видим в раннем, самом раннем, а именно превентивном лечении эпилепсии с применением АЭП в порядке специфической профилактики манифестных форм эпилепсии вообще и ее резистентных к лечению вариантов, в частности. Однако оказалось, что к настоящему времени эпилептология не располагает ни научным обоснованием, ни методикой проведения превентивной антиэпилептической терапии. Предстояло заполнить эти пробелы собственными исследованиями. Мы обратились к истокам заболевания, к периоду детства потому, что именно на этот возраст падает, преимущественно, начало заболевания, а основную часть взрослых больных составляют выросшие дети с не вылеченной эпилепсией.
В качестве научного обоснования превентивного антиэпилептического лечения нами разработано учение о донозологическом периоде эпилепсии (ДПЭ), периоде формирования болезни от первых ЦП до состоявшихся клинических форм. Гипотеза о существовании ДПЭ у детей была выдвинута уже на основании данных литературы, среди которых нас заинтересовали три категории научных фактов: первая – ремиссия после первого неспровоцированного ЭП, может продолжаться неопределенно долго [Болдырев А.И., 1987; Besser R., Kramer G., 1983; Kumamoto R., 1971]; вторая – рецидивы после первого ЭП наступают далеко не у всех больных [Cleland P.G., Steward W.D., Mosquera I., 1981; Colomy J., 1980; Hart R.G., Faston J.D., 1988], в связи с чем, количество лиц среди взрослых, перенесших единственный в жизни ЭП в 5 раз, а среди детей – в 10 раз превышает количество больных собственно эпилепсией [Janz D., 1969; Hauser W.A., 1994]; третья – первому спонтанному ЭП у детей нередко предшествуют повторные неэпилептические ЦП (Асанова Л.М.-Б., 1990; Болдырев А.И., 1990; Кельин Л.Л., 1990; Betts T., 1990; King D.W., 1982 и др.). При анализе этих фактов резонно возникли следующие вопросы, например: «Почему у части детей первые ЭП рецидивируют и заболевание в целом прогрессирует в эпилепсию, а у других – они остаются единственными ЭП в анамнезе?» Или: «Почему у многих детей повторные неэпилептические ЦП протекают доброкачественно и имеют благоприятный исход, включая выздоровление порою даже без лечения, а у некоторых – они сменяются рецидивирующими ЭП?».
В качестве ответов на эти вопросы нами предложена концепция ДПЭ у детей. В связи с тем, что данный период выделяется впервые в эпилептологии, представляется целесообразным изложить основные положения выдвинутой концепции, которые состоят в следующем.
Первый в жизни ребенка ЭП отнюдь не означает, что он уже болен эпилепсией, или с фатальной неизбежностью заболеет ею в будущем.
Повторные неэпилептические ЦП у детей не всегда протекают благоприятно, и у некоторых из них являются предвестниками развертывания ЭП.
Эпилепсией заболевают не все дети, перенесшие первый ЭП или повторные неэпилептические ЦП, но лишь те из них, которые обладают констелляцией необходимых патологических условий – факторов риска, определяющих эволюцию заболевания в сторону эпилепсии.
Даже при наличии факторов риска необходимо определенное время для формирования заболевания от первых ЦП до обоснованно диагностированных клинических форм эпилепсии.
ДПЭ не является скрытым, латентным периодом, но имеет определенное клиническое, патофизиологическое содержание и протяженность во времени, подлежащие исследованию.
Было бы неправильным безоговорочно разделять и противопоставлять неэпилептические ЦП и ЭП у всех больных и во всех клинических ситуациях. Конкретно речь идет о том, что любые ЦП, оказавшиеся в ДПЭ, при определенных условиях могут представлять собой своеобразную прелюдию состоявшихся форм эпилепсии, и поэтому должны обладать определенной степенью общности своей неврологии, которую также необходимо выявить и исследовать.
Донозологический период не дает права поставить диагноз эпилепсии, однако его выделение может служить научным обоснованием реального прогнозирования развертывания как первых ЭП, так и их рецидивов, а также позволяет выделить из детской популяции группы детей с высоким риском заболевания эпилепсией для проведения им превентивного лечения с применением АЭП в течение периода времени не меньшего, чем продолжительность ДПЭ.
2.Материалы и методы исследования.
Все эти вопросы, важные как в теоретическом, так и практическом отношении разрабатывались на материале комплексного исследования в условиях детского неврологического стационара 990 детей с ЦП в возрасте от 1 мес. до 15 лет, из которых 54% составили мальчики и 46% - девочки. Были выделены 3 группы наблюдений. Первую группу составили 460 детей больных эпилепсией, из которых заболевание проявлялось только генерализованными ЭП у 76,4%, только парциальными ЭП – у 9,3% и генерализованными и парциальными ЭП – у 14,3% больных. Основным критерием диагностики заболевания служил синдром повторных спонтанных ЭП, которые не были спровоцированы ни очевидными факторами, ни текущим органическим заболеванием мозга. Анамнестические данные полученные от больных этой группы и их родственников, анализ истории развития ребенка, составили основу представлений о динамике пароксизмального синдрома в ДПЭ от первых ЦП до состоявшихся форм заболевания, соответствующих критериям ВОЗ. Была также определена средняя продолжительность ДПЭ и выделены значимые факторы риска развертывания первых ЭП и их рецидивов.
Во вторую группу наблюдений вошли 530 больных, у которых в процессе обследования и дифференциальной диагностики диагноз эпилепсии был отклонен. Общая клиническая структура и удельный вес ЦП у больных этой группы представлены на рисунке 1 и таблице 1. Это оказалась сборная группа различных заболеваний, основным клиническим проявлением которых, были неэпилептические ЦП (290 больных) и единичные эпилептические припадки (240 больных). В систематизации этих приступов использовали традиционные, сложившиеся в клинической практике названия, придерживаясь, где это возможно, рекомендаций ВОЗ по классификации ЦП [H. Gastaut, 1975]. Так, из общего количества наблюдений второй группы, ЦП инфекционного и инфекционно-токсического генеза оказались у 130 (25,4%) больных: фебрильные припадки – у 104 и энцефалическая реакция с пароксизмальным синдромом – у 26; парасомнии у 102 (19,2%): ночные страхи – у 48, миоклонии во сне – у 31 и снохождения – у 23 больных; эпилептический синдром в клинической картине перинатальной энцефалопатии – у 82 (15,5%); аффективно-респираторные припадки – у 70 (13,2%); обмороки – у 30 (5,4%); единичные спонтанные ЭП – у 28% (5,2%); вегетативные ЦП – у 16 (3,4%); метаболические ЦП – у 8 (1,5%) и сочетания нескольких разновидностей ЦП у одного больного – у 64 (12,1%) больных. У детей этой группы производился поиск значимых факторов риска по эпилепсии, результатом которого являлось прогнозирование дальнейшего возможного развития заболевания в каждом наблюдении и выделение по определенной схеме больных с высокой степенью риска по формированию у них эпилепсии, в третью группу наблюдений.
Третью группу наблюдений составили 227 детей, из которых 161 были с единичными ЭП и 66 – с повторными неэпилептическими ЦП. Анализ наблюдений данной группы представлен в 3 главе. Примечательная особенность этой группы состояла в том, что кроме самого факта наличия ЦП, все дети являлись носителями и других значимых факторов риска по эпилепсии, и в тоже время диагноз эпилепсии у них являлся невозможным и был отклонен. Именно у этих больных заболевание расценивалось как находившееся в ДПЭ и в соответствии с задачами настоящего издания у них исследовалась его неврология – этиология, патофизиология, клиника и топический диагноз пароксизмов. Сами же эти больные предназначались для активного диспансерного наблюдения и проведения им научно обоснованной превентивной антиэпилептической терапии с включением в лечебный комплекс постоянного приема профилактических доз АЭП.
ДПЭ у детей представляет собой прежде всего клиническую категорию, поэтому основным методом исследования был клинический. Большое внимание уделялось повторному расспросу больного и его родственников, анализу медицинских документов и, в частности, истории развития ребенка, начиная с
Эпилептические припадки Неэпилептические ЦП
240 больных 290 больных
(45,3%) (54,7%)




![]()

![]()

![]()
![]()

![]()

![]()
![]()

![]()
Рисунок 1. Общая клиническая структура второй группы наблюдений
Т аблица
1. Количество
больных и
рубрификация
ЦП второй группы
наблюдений.
аблица
1. Количество
больных и
рубрификация
ЦП второй группы
наблюдений.
|
№№ пп |
Название ЦП | Количество больных | % |
| 1 | Фебрильные припадки | 104 | 19,5 |
| 2 | Энцефалическая реакция | 26 | 5,0 |
| 3 | Ночные страхи | 48 | 9,1 |
| 4 | Ночные миоклонии | 31 | 6,0 |
| 5 | Снохождения | 23 | 4,1 |
| 6 | Эпилептический синдром | 82 | 15,5 |
| 7 | Аффективно-респираторные припадки | 70 | 13,2 |
| 8 | Обмороки | 30 | 5,4 |
| 9 | Спонтанные эпилептические припадки | 28 | 5,2 |
| 10 | Вегетативные пароксизмы | 16 | 3,4 |
| 11 | Метаболические пароксизмы | 8 | 1,5 |
| 12 | Сочетание пароксизмов | 64 | 12,1 |
| Всего | 530 | 100,0 |
выписки из родильного отделения. Главной жалобой больных являлись пароксизмы, которые следовало идентифицировать, поэтому первым этапом диагностики заболевания было выяснение клинических проявлений приступа. Для этого каждый пароксизм условно подразделяли на несколько фаз: начальную, фазу развернутых проявлений, заключительную часть и послеприступное состояние. Выясняли клиническое содержание, продолжительность отдельных фаз и припадка в целом, наличие и характер судорог, состояние сознания во время приступа. Нередко, продолжительность пароксизма, приближающаяся к истинной, устанавливалась посредством устного моделирования его клинических проявлений в присутствии очевидцев с регистрацией отсчёта времени по секундомеру с интервалом в 5 сек. Анализировались обстоятельства развертывания пароксизма, время суток, характер занятий больного перед приступом, положение его тела и поза, общее состояние в день приступа и накануне, особенности режима дня и питания, в поисках возможных провоцирующих факторов. Отдельно учитывались частота, возможная цикличность, эволюция клинических проявлений и обстоятельств развертывания пароксизмов, феномены трансформации и полиморфизма. Состояние поведения и психики анализировалось по данным анамнеза заболевания, истории развития ребенка, личного контакта и наблюдения за больным в стационаре. При необходимости включения нарушений психики в диагноз заболевания, больные консультировались психиатром.
Из дополнительных методов исследования всем больным эпилепсией и больным группы риска произведены обзорная краниография в двух проекциях, эхоэнцефалоскопия, офтальмологическое исследование. По показаниям применяли реоэнцефалографию, транскраниальную допплерографию, нейросонографию, компьютерную томографию, биохимические и некоторые другие методы исследования. Всем больным произведено электроэнцефалографическое исследование (ЭЭГ). Регистрация биопотенциалов мозга производилась 8-ми канальным электроэнцефалографом «Bioscript» и 16-ти канальным аппаратом «Neirofax» фирмы «Nichon-Koden». Электроды на кожных покровах головы пациента располагались по схеме, разработанной H. Джаспером [1958], известной в клинической ЭЭГ под названием схемы «10-20». В каждом исследовании использовались два способа отведения потенциалов – биполярный и монополярный. Фильтры низких частот на приборе устанавливались в диапазоне 35 Гц, постоянная времени составляла 0,3, скорость движения бумаги – 30 мм в 1 сек., величина калибровочного сигнала – 50 мкВ.
ЭЭГ регистрировали в покое, в состоянии физиологического бодрствования и при специальных функциональных нагрузках. Стандартные пробы включали в себя реакцию активации, ритмичную фотостимуляцию и гипервентиляцию. В качестве дополнительных функциональных проб, направленных на активацию патологической ЭЭГ активности, по показаниям, применяли фармакологический сон и депривацию сна. Начальная стадия фармакологического медленного сна использовалась для регистрации ЭЭГ преимущественно у детей раннего возраста и достигалась премедикацией больных посредством введения через клизму 2% раствора хлоралгидрата в возрастных дозировках. Частичная депривация сна осуществлялась по методике M.C. Arne-Bes [1982]. Ребенка будили в 2 часа ночи и он находился в состоянии активного бодрствования до 13 часов, после чего производилась регистрация ЭЭГ в состоянии расслабленного бодрствования. Оценку данных ЭЭГ производили с учетом возрастных особенностей формирования физиологического созревания основных биоэлектрических ритмов мозга согласно критериям разработанным H. Gastaut и J.L. Gastaut [1980].
ГЛАВА 1. ФОРМИРОВАНИЕ ЭПИЛЕПСИИ У ДЕТЕЙ.
1.1. Церебральные пароксизмы в детской неврологической клинике.
Данные литературы о частоте ЦП весьма неполны, что можно отчасти объяснить отсутствием их общепринятой классификации, однако имеющиеся данные вызывают тревогу. Так например, частота только судорожных пароксизмов у детей достигает 14% [Kreindler A. и соавт., 1963]. Обнаружено, что в детском возрасте ЦП встречаются в 5-10 раз чаще, чем у взрослых [Сараджишвили П.М., Геладзе Т.Ш., 1977; Jepas J., Tivadar I., 1973], причем до 60% их приходится на первые 3 года жизни [Асанова Л.М.-Б., 1990; Мурадян Г.Т., 1976].
Впечатляет и большое клиническое разнообразие ЦП, развертывающихся в детском возрасте. Значительная их часть является ЭП, остальные относятся к неэпилептическим ЦП. Таковы, например, обмороки, аффективно-респираторные припадки, метаболические судороги, парасомнии и др. Однако все они имеют общий, объединяющий их признак – пароксизмальность, и поэтому поддаются общему, универсальному определению. В литературе последних лет мы встретили три созвучных между собой определения [Карлов В.А., 1995; Шанько Г.Г., 1990; Gastaut H., 1975]. Наиболее развернутым нам представляется определение последнего автора, одобренное комитетом экспертов ВОЗ по эпилепсии в 1975 г.: «Церебральный пароксизм (приступ, припадок) представляет собой внезапно возникающее, преходящее, не контролируемое больным патологическое состояние, характеризующееся разнообразными моторными, сенсорными, вегетативными или психическими феноменами, появляющимися в результате временной дисфункции всего мозга или каких-либо его систем. Приступ развертывается либо на фоне полного внешнего здоровья, либо при внезапном ухудшении хронического патологического состояния».
Единая классификация ЦП, удовлетворяющая потребности клиники еще не разработана, хотя основные принципы ее построения предложены В.А. Карловым [1995]. Этих принципов оказалось три: этиологический, патогенетический и клинический. Г.Г. Шанько [1990] выделяет три группы ЦП: эпилептические, неэпилептические и ЦП занимающие промежуточное положение между первыми двумя группами, и примерами которых автор называет фебрильные и аффективно-респираторные припадки. Более полной является классификация Гасто [1975], построенная на этиологическом и патогенетическом принципах. Она включает в себя 7 групп ЦП, из которых первую группу представляют ЭП, следующие 5 групп относятся к неэпилептическим ЦП и последняя представлена ЦП неопределенного генеза.
Эпилептические припадки – вызываются чрезмерным, гиперсинхронным разрядом нейронных популяций, который распространяется на одну или несколько функциональных систем мозга, либо на весь мозг и на нейромышечную и нейровисцеральную периферию. Повторные спонтанные ЭП составляют собой основное клиническое проявление эпилепсии.
ЦП аноксического (гипоксического, ишемического, асфиксического) генеза, например, приступы ишемии ствола головного мозга типа drop attacks, обмороки, приступы ассоциированной мигрени, аффективно-респираторные припадки, ларингоспазм у больных тетанией.
ЦП токсического и инфекционно-токсического генеза – при отравлениях ядами, токсинами, нейролептиками и др. Примерами могут быть ЦП при интоксикации стрихнином, окисью углерода, препаратами ртути, алкоголем, судороги при заболевании столбняком, бешенством и др.
ЦП метаболической природы – гипогликемические , тетанические судороги, судороги при гемолитической болезни новорожденных, при микседеме, болезни Аддисона и др.
Гипнические ЦП группируются в два основных класса: пароксизмальные гиперсомнии и пароксизмальные парасомнии. Первые представляют собой нарушения бодрствования и проявляются приступами патологической сонливости, например, при нарколепсии, синдромах Пикквика, Клейне-Левина, истерической спячки и др. Парасомниями называют неэпилептические ЦП, развертывающиеся во время сна, например: миоклонии, бруксизм, ночные страхи, кошмары, снохождения, апноэ во сне, энурез и др.
Психогенные ЦП. Их также называют демонстративными припадками, к которым относят аффективно-респираторные припадки, разнообразные пароксизмы при истерическом неврозе и др.
ЦП неопределенного генеза, обусловленные механизмами и причинами, не связанными с названными выше факторами. Некоторые авторы относят к этой группе доброкачественные приступы головокружения у детей, приступы эсенциальной невралгии тройничного нерва, абдоминальные приступы у детей, судорожные приступы у больных сирингомиелией, рассеянным склерозом и др. [Gastaut H., 1970; Schmitt J., 1979].
Приведенная классификация достаточно активно используется в научных исследованиях, однако не получила широкого распространения в повседневной клинической практике, в которой чаще применяются исторически сложившиеся названия ЦП, например: мигрень, обмороки, фебрильные припадки и др., и где традиционно все ЦП делятся на эпилептические и неэпилептические, судорожные и бессудорожные.
Классификация ЭП регулярно подвергается пересмотру международным сообществом эпилептологов. Кроме того, в практической эпилептологии широко применяется и систематизация патологических состояний сопровождающихся ЭП по принципу основного патологического процесса, изложенная в терминологическом словаре по эпилепсии [Gastaut H., 1975] и подробно разработанная А.И. Болдыревым [1984] и др. Она содержит несколько разновидностей патологических состояний, в рамках которых следует идентифицировать ЭП: спонтанные случайные припадки, эпилептическую реакцию, эпилептический синдром и эпилепсию (эпилептическую болезнь). Первые три рубрики предполагают как единственные в жизни, так и повторные ЭП у человека еще не болеющего эпилепсией и четвертая – только повторные спонтанные ЭП. Данная систематизация хороша тем, что в определенной степени объективно отражает этапность и обратимость эпилептогенеза, процесс формирования эпилепсии, занимающий определенное время и позволяет смело утверждать, что далеко не у каждого ребенка однократное, а иногда и повторное развертывание ЭП означает, что этот ребенок уже болен эпилепсией или непременно заболеет ею в будущем. Вот почему частота единичных ЭП в детской популяции на порядок превышает частоту собственно эпилепсии.
Что касается неэпилептических ЦП, то в настоящее время их чаще называют по основным клиническим проявлениям, например: «ночные страхи», «ларингоспазм», «гипогликемические судороги» и др., либо исторически сложившимися названиями «нарколепсия», «обмороки» и др. В качестве названия неэпилептических ЦП был предложен термин «псевдоприпадки» подчеркивающий их неэпилептическую природу [Betts T., King D.W. et all., 1982$ Schmitt J., 1979]. Исследованию частоты неэпилептических ЦП у детей долгое время не уделялось должного внимания в связи с господствовавшими консервативными представлениями об их исключительной доброкачественности и благоприятном прогнозе. В последнее время, в связи с возросшим интересом к неврологии ЦП вообще и появившимися фактами, указывающими на возможность преемственной связи неэпилептических ЦП с развитием в последующем у этих больных эпилепсии, таковые статистические данные начинают появляться. Например, аффективно-респираторные припадки наблюдаются у детей в возрасте до 4 лет с частотой от 9,3% до 13% [Lehovsky M., 1979], обмороками страдают до 6,8% детей [Акимов Г.А., Ерохина Л.Г., Стыкан О.А., 1987] и неэпилептическими парасомниями – свыше 18% детей и подростков [Бибилейшвили Ш.Н., 1975; Болдырев А.И., 1987; Hallstrom T., 1972 и др.].
Среди неучтенных классификацией Гасто в детском возрасте часто встречаются и другие, весьма многочисленные вегетативно-сосудистые и вегетативно-висцеральные ЦП, диагностируемые в рамках «невроза», «псевдоневроза», «вегетативной дистонии», «гипоталамического», «психо-вегетативного» синдромов и др. Приводим материал собственных наблюдений ЦП у детей. Из рисунка 2. следует, что основной клинический синдром заболевания проявлялся эпилептическими припадками у 700 больных (70%) и неэпилептическими ЦП – у 290 (30%). Таблицы 2. и 3. иллюстрируют клиническую рубрификацию и количественную характеристику наблюдаемых ЦП у детей
Неэпилептические ЦП Эпилептические припадки
290 больных ( 30%) 700 больных ( 70%)

Рисунок 2. Общая клиническая структура ЦП у детей (собственные наблюдения)
Таблица 2. Рубрификация патологических состояний с ЭП в клинической картине (собственные наблюдения)
|
пп |
Название рубрики | количество больных | % |
| 1 | Эпилепсия | 460 | 65,7 |
| 2 | Эпилептическая реакция | 130 | 18,6 |
| 3 | Эпилептический синдром | 82 | 11,7 |
| 4 | Единичные спонтанные ЭП | 28 | 4,0 |
| 5 | Всего | 700 | 100,0 |
Таблица 3. Рубрификация неэпилептических ЦП (собственные наблюдения)
|
пп |
Название ЦП | Количество больных | % |
| 1 | Ночные страхи | 48 | 16,6 |
| 2 | Ночные миоклонии | 31 | 10,7 |
| 3 | Снохождения | 23 | 8,0 |
| 4 | Аффективно-респираторные припадки | 70 | 24,1 |
| 5 | Обмороки | 30 | 10,3 |
| 6 | Вегетативные пароксизмы | 16 | 5,5 |
| 7 | Метаболические пароксизмы | 8 | 2,7 |
| 8 | Сочетания пароксизмов | 64 | 22,1 |
| 9 | Всего | 290 | 100,0 |
Вцелом, классификация Гасто имеет существенные недостатки и это не случайно. Она не является до конца патогенетической. Например, термин «гипнический» припадок не означает порожденный или вызванный сном, но лишь связанный с периодом сна. Классификация не предполагает и полного разграничения причин и механизмов развития ЦП. Например, хорошо известна тесная связь ЭП с периодом сна, а также возможность провоцирования их гипогликемией, эмоциональными стрессами, интоксикацией и другими факторами, лежащими в основе и неэпилептических ЦП. Или обморок, являясь разновидностью гипоксических пароксизмов, может быть вызван психогенным фактором, или гипогликемией, которую следует относить к метаболическим факторам. Кроме того, выделение рубрики ЦП неопределенного генеза позволяет предположить наличие пароксизмов не отвечающих критериям ни одной из выделенных групп, либо, возможно, как эпилептические, так и неэпилептические механизмы происхождения. Таким образом, определенная общность всех ЦП заложена в самой их природе и она не могла не отразиться на анализируемой классификации, призванной разделить ЦП.
Между тем, данные литературы также свидетельствуют о том, что абсолютное разделение и полное противопоставление неэпилептических и эпилептических ЦП у всех больных и в любых клинических ситуациях невозможно. Стало известно, например, что неэпилептические ЦП встречаются в личном анамнезе детей больных эпилепсией значительно чаще, чем в детской популяции вцелом [Болдырев А.И., 1990; Сараджишвили П.М., Геладзе Т.Ш., 1977; Janz D., 1969; King D.W., 1982; Kreindler A., 1963]. Некоторые больные с повторными неэпилептическими ЦП расцениваются как угрожаемые по эпилепсии и им не назначается профилактическая антиконвульсантная терапия [Ерохина Л.Г., Григорьева Л.С., 1979; Ратнер А.Ю., и соавт., 1987; Robb R.R., Ekman P.B., 1972; Whitty C.W., 1971 и др.]. Описываются наблюдения с сосуществованием неэпилептических и эпилептических ЦП у одного больного [Кельин Л.Л., Буздин В.В., 1987; Brocker H., Wuller D., Wilbner B., 1989; Koupernik C., 1974 и др.] и выделяются единые звенья патогенеза эпилептических и неэпилептических ЦП [Геладзе Т.Ш., Николаишвили Р.Г., 1988; Елигулашвили Г.С., Бинауришвили Р.Г., 1985; Ерохина Л.Г., Григорьева Л.С., 1980; Карлов В.А. 1995].
Следовательно, у некоторых больных эпилепсия представляет собой модель заболевания, созревающего постепенно и имеющего при этом весьма необычные характеристики, а именно: наличие периода заболевания, представленного повторными неэпилептическими пароксизмами, затем периода одновременного развертывания неэпилептических и эпилептических ЦП и лишь только потом – вступление заболевания в период развернутых клинических проявлений, главным содержанием которого становятся повторные спонтанные ЭП. В этих наблюдениях на поверхности событий может оказаться процесс «трансформации не эпилепсии в эпилепсию». Традиционное мышление врача, основанное на абсолютном разделении и полном противопоставлении неэпилептических и эпилептических ЦП с подобной «трансформацией» согласиться не может, что приводит к игнорированию очевидных клинических фактов, к ошибкам врачебной тактики, жертвой которых становится ребенок, страдающий пароксизмами. Нам представляется, что приведенные выше «неудобные» факты, имеющие место в формировании эпилепсии у детей не следует отбрасывать по принципу «не может быть!», но попытаться объяснить их с позиций возможной неврологической общности неэпилептических и эпилептических ЦП, и этапности процесса эпилептогенеза, предполагающего у каждого ребенка больного эпилепсией существование донозологического периода заболевания, основным клиническим содержанием которого могут быть не только логично предполагаемые единичные ЭП, но и повторные неэпилептические ЦП, а также сочетания неэпилептических и эпилептических ЦП у одного больного.
1.2. Донозологические проявления эпилепсии у детей по данным литературы.
Эксперты ВОЗ определяют эпилепсию у человека как хроническое заболевание головного мозга или как болезненное состояние, имеющее в различных случаях различную этиологию и характеризующуюся повторными припадками, вызываемыми различными механизмами. Согласно этому определению главным клиническим проявлением эпилепсии являются спонтанные, повторно развертывающиеся ЭП. Среди механизмов развертывания ЭП наиболее изученным является гиперсинхронный, чрезмерный разряд нейронных популяций, охватывающий одну или несколько функциональных систем мозга, либо распространяющийся на весь мозг, а также на нейромышечную и нейровисцеральную периферию. В течение нескольких последних десятилетий наиболее адекватной и доступной методикой регистрации «чрезмерных нейронных разрядов» зарекомендовала себя ЭЭГ, которая характеризуется у больных эпилепсией специфическими графоэлементами – «пиками» и комплексами «пик-волна». Известно также, что в типичных случаях и особенно при прогрессирующем течении эпилепсия сопровождается выраженными нарушениями психики. Задачей настоящего издания является изложение донозологических проявлений эпилепсии, не содержащих еще ни достаточной выраженности, ни сочетания пароксизмального синдрома, нарушений психики и ЭЭГ изменений, достаточных для постановки диагноза эпилепсии, но которые являются необходимым этапом эпилептогенеза у каждого больного. Анализ литературы показал, что донозологический период эпилепсии к настоящему времени еще не выделен. Его определения, описания клинического содержания и патофизиологической сущности не содержит ни терминологический словарь по эпилепсии, ни известные классификации этого заболевания. Для обозначения начальных этапов эпилептогенеза и ранних проявлений эпилепсии исследователи использовали различные термины, например, «скрытая», «латентная», «маскированная» эпилепсия и др. Латентный период эпилепсии выделяли Н.В. Поповиченко и С.Д. Расин [1977] и исчисляли его с момента воздействия первичного патогенного фактора до первого эпилептического припадка. По данным авторов продолжительность этого периода колебалась от нескольких месяцев до нескольких лет. D. Schmidt [1984] считал «латентной» эпилепсией все наблюдения, в которых типичные эпилептические ЭЭГ изменения регистрировались у клинически здоровых лиц. A. Metthes [1984] называл подобные случаи «биоэлектрической» эпилепсией. «Скрытую» эпилепсию выделяли П.А. Наджаров и Н.С. Шумский [1960], а H.D. Peterman и Ch. Grubler [1971] использовали термин «маскированная» эпилепсия для обозначения неэпилептических ЦП у детей, сопровождающихся специфическими для эпилепсии изменениями ЭЭГ.
Другие авторы выделяли «продромальные» признаки эпилепсии и «продромальную» стадию этого заболевания. Например R. Kumamoto [1971] продромальными признаками эпилепсии считал неэпилептические ЦП, без специфических изменений на ЭЭГ. По его данным эти пароксизмы могли продолжаться многие годи и у 50% больных заканчивались эпилепсией. Г.Б. Абрамович [1965, 1969] отмечал, что развертыванию первых эпилептических припадков у детей нередко предшествуют разнообразные перманентные нарушения поведения и психики невротического типа, а также пароксизмы в виде головной боли, головокружений, вегетативно-висцеральных приступов, пароксизмальных нарушений сна и др. Почти у половины взрослых больных эпилепсией А.И. Болдырев [1967,1984] выделял «продромальную» стадию заболевания, продолжительностью от нескольких месяцев до нескольких лет. К ее клиническим проявлениям автор относил вздрагивания при засыпании и во сне, другие парасомнии, головные боли, различные «микропароксизмальные» (редакция А.И. Болдырева) синдромы, астенические проявления и др. При эпилепсии у детей автор выделял пароксизмальные расстройства инициального периода заболевания, развертывающиеся за несколько месяцев или лет до первого спонтанного эпилептического судорожного припадка: парасомнии, пароксизмальные цефалгии, фебрильные припадки, приступы головокружения, дисфорические состояния, абдоминальные кризы, аффективно-респираторные припадки, обмороки и др. [Болдырев А.И., 1987].
Г.Л. Воронков [1972] отмечал возможность манифестации эпилепсии у детей через несколько лет после перенесенных первичных судорожных пароксизмов. Он назвал этот феномен «прерывистым» дебютом эпилепсии у детей. Кроме того, автор ввел понятие «начального эпилептического синдрома» включающего в себя разнообразные бессудорожные ЦП, сочетающиеся с астенией, гиперактивностью, расторможенностью детей. Все эти нарушения предшествовали за несколько месяцев или лет первому спонтанному судорожному ЭП.
К настоящему времени накоплены данные и по конкретной связи с эпилепсией отдельных разновидностей ЦП, наиболее актуальных для детского возраста, причем, одни авторы расценивали их в качестве факторов риска по эпилепсии [Карлов В.А., 1990; Colomy J.P., 1975; Eriksson M., 1975 и др.] другие – относили к продромальным ее проявлениям [Асанова Л.М.-Б., 1990; Гедекова А., 1989; Hagberg G., Hansson O., 1976 и др.] и третьи – включали их в клиническую структуру манифестных проявлений эпилепсии у детей [Болдырев А.И., 1988; Буздин В.В., 1980; Curatolo P., 1980 и др.].
К факторам риска по эпилепсии В.А. Карлов [1990] относит следующие детские ЦП: судороги новорожденных, судороги детей младенческого возраста, фебрильные и аффективно-респираторные припадки, тетанические судороги, парасомнии.
Тесную связь неонатальных судорог с развивающейся в последствии у части из этих детей эпилепсией отмечали многие авторы, при этом исход в эпилепсию в данных исследованиях колебался от 10% до 50% наблюдений [Бондаренко Е.С. и соавт., 1982; Буркова А.С. и соавт., 1980; Гузева В.И., 1992; Keen J.H., Lee D., 1973 и др.]. Речь идет о судорогах при асфиксии новорожденных, судорожных припадках при внутричерепной родовой травме, судорогах при гемолитической болезни новорожденных, тетанических, гипогликемических, гипернатриемических, гипонатриемических, пиридоксинзависимых судорогах, гиперпиретических судорогах неинфекционного характера, доброкачественных судорогах и доброкачественных семейных судорогах новорожденных.
Кроме типичных генерализованных и парциальных судорожных припадков, неблагоприятное относительно эпилепсии прогностическое значение отмечено и для неразвернутых, атипичных и бессудорожных ЦП неонатального периода: тонических судорог по типу децеребрационной ригидности, опистотонуса, гемиконвульсий, общих и локальных вздрагиваний, судорог по типу торсионного спазма и спастической кривошеи, спазмов взора с закатыванием глазных яблок, фаринго-оральных феноменов, пароксизмальных движений конечностей, напоминающих плавание, езду на велосипеде, пароксизмов цианоза, покраснения или побледнения кожных покровов, тахи- и брадикардии, апноэ, тахи- и брадипноэ и др. [Бондаренко Е.С. и соавт., 1982; Janetti P., 1975; Noetzel M.J., 1992 и др.].
Проблеме фебрильных припадков у детей и их связи с развивающейся в последствии эпилепсией посвящена обширная литература, причем степень риска выхода данной патологии в эпилепсию достигает 77% [Алимов И.Ю., 1988; Харитонов Р.Н., Кельин. Л.Л., 1990; Nelson K.D., Elenberg J.H., 1986; Laditan A.A., 1994, и др.]. Столь существенные позиции фебрильных припадков в качестве фактора риска по эпилепсии у детей, объясняются определенной степенью общности их неврологии с эпилепсией. Действительно, основным этиологическим фактором фебрильных припадков является органическое повреждение мозга, полученное в периоде беременности и родов; около 30% больных имеют наследственность, осложненную по эпилепсии и другим ЦП и у 1/3 детей фебрильные припадки рецидивируют при повторении у ребенка лихорадочных эпизодов. Выделены и факторы риска последующего развития эпилепсии, например: рецидивы припадков при очередных эпизодах лихорадки, серийность, либо статусное течение припадков, парциальный характер, продолжительность судорожного эпизода более 15 мин, развертывание припадков в процессе снижения температуры тела, осложнение наследственного анамнеза по эпилепсии, пароксизмальная активность на ЭЭГ, очаговая неврологическая симптоматика в преморбидном периоде, либо существенные анамнестические указания на возможность перенесенного органического повреждения мозга (асфиксия в родах, вынужденное оперативное родоразрешение, наложение акушерских щипцов и др.) J.F. Annegers [1987] разработал методику подсчета прогрессирующей степени риска перехода фебрильных припадков в эпилепсию, основанную на сочетании у одного ребенка количества рецидивов фебрильных припадков и других факторов риска по эпилепсии: при наличии одного фактора риска и одного фебрильного припадка риск выхода в эпилепсию составляет 2%, при сочетании 2 факторов риска и одного фебрильного припадка – 10% и т.д. Сущность такого градуирования риска состоит в том, что чем больше факторов риска и рецидивов фебрильных припадков сочетаются у одного больного, тем выше у него вероятность заболевания эпилепсией.
Аффективно-респираторные судороги по данным M. Lehovsky [1979] составляет 13% судорожных состояний у детей в возрасте до 4 лет. Если принять во внимание, что примерно у половины больных аффективно-респираторные припадки (АРП) протекают без судорожного компонента, то их частота в раннем детстве еще выше. Как правило, эти припадки начинаются на первом году жизни и после 3-х летнего возраста встречаются редко. Клиническая картина представляет собой спровоцированный психо-эмоциональными факторами приступ потери сознания, продолжительностью до нескольких минут, сопровождающийся апноэ, цианозом или побледнением лица и нередко генерализованными тоническими судорогами.
Относительно связи АРП с эпилепсией в литературе нет единого мнения. Одни авторы относят АРП всегда и безусловно к неэпилептическим пароксизмам психогенного и в тоже время гипоксического генеза [Ковалев В.В., 1979; Коровин А.М., 1984], другие – к переходным ЦП, объединяющим в себе неэпилептические и возможно эпилептические механизмы [Кельин Л.Л., 1990; Натриашвили Г.Д., 1987], третьи – к факторам риска по эпилепсии у детей [Карлов В.А., 1990; Харитонов Р.А. и соавт. 1990; Lanz D., Scheffner D., 1980]. Для настоящего издания целесообразно отметить также, что эпилепсия чаще развивается у детей с АРП в анамнезе, чем в среднем в популяции [Карлов В.А., 1990; Шамансуров Ш.Ш., Рафикова З.Б., 1990; Lanz D., 1980]. В целом, по данным литературы и собственным наблюдениям [Миридонов В.Т., 1994] АРП также могут составить клинику донозологического периода эпилепсии у детей.
Среди гипоксических пароксизмов актуальными для детского возраста являются судорожные припадки при асфиксии новорожденных, обмороки, гипервентиляционные кризы, беттолепсия. Как правило, при своих типичных проявлениях они не представляют собой существенных проблем ни в позитивной диагностике, ни в дифференциации их с ЭП. Исключение составляют судорожные припадки при асфиксии новорожденных, которые появляются в первые часы и сутки неонатального периода. Судороги имеют генерализованный тонический или тонико-клонический характер, сопровождаются утратой сознания, продолжаются до нескольких минут и развертываются обычно у детей с признаками «синей» или «белой» асфиксии. В настоящее время становятся общеизвестными и трудности дифференцирования этих ЦП с ЭП и тесная их связь с развивающейся в последующем у части из этих детей эпилепсией. Для отдельных же разновидностей гипоксических ЦП обе выше названные проблемы возникают редко и лишь при атипично протекающих пароксизмах, имеющих в своих клинических проявлениях и обстоятельствах развертывания некоторые признаки ЭП. Если к тому же у этих больных обнаруживается в межприступном периоде пароксизмальная активность на ЭЭГ, то при сохранении в диагнозе неэпилептического характера ЦП им назначается продолжительный прием АЭП с хорошим эффектом.
Например, ряд авторов отмечали клиническую общность, общие ЭЭГ корреляты и преемственную связь между беттолепсией и эпилепсией [Ерохина Л.Г., 1975; Геладзе Т.Ш. и соавт., 1985; Kamio M., 1976]. Было показано, что наследственный анамнез больных обмороками нередко осложнен по эпилепсии и другим ЦП [Акимов Г.А.. Ерохина Л.Г., Стынан О.А., 1987; Jonstone M., 1976]. В работах Л.Г. Ерохиной выделена обморокоподобная форма эпилепсии [Ерохина Л.Г., 1977, 1980]. Обморокоподобные ЦП автор наблюдала в качестве первых пароксизмов при эпилепсии, переходных вариантов между неэпилептическими и эпилептическими припадками у одного больного в процессе формирования эпилептогенеза, а также в качестве единственных пароксизмальных проявлений эпилепсии в манифестной стадии заболевания.
К настоящему времени накоплена обширная литература, касающаяся разнообразных нарушений сна и бодрствования и возможной связи некоторых из них с эпилепсией [В.В. Буздин, 1989; Гольбин А.Ц., 1979; Cadhillac J., 1982; Jonson L.C., 1982 и др.]. Существует международная ассоциация центров по изучению сна, которая предложила единую классификацию нарушений сна и бодрствования у человека, содержащую 4 основные позиции: инсомнии (диссомнии) – субъективная неудовлетворенность качеством и количеством сна, ощущение неполноценности сна; парасомнии – пароксизмально протекающие аномальные феномены, встречающиеся во сне; гиперсомнии – патологическая сонливость в дневное время; нарушения циркадного ритма сон-бодрствование.
Задачи настоящего издания обусловили наш интерес преимущественно к парасомниям, которые называют также гипническими пароксизмами [Gastaut H.,1975] и пароксизмальными нарушениями сна [Болдырев А.И., 1988; Кравцов Ю.И., Малов А.Г., 1992 и др.]. Следует оговориться, что в настоящем разделе имеются в виду неэпилептические парасомнии, диагностируемые в клинической практике чаще всего в рамках невроза, невропатии, неврозоподобного синдрома и др. Клиническая семиология этих приступов состоит из нарушений поведения, а также преимущественно двигательных и вегетативно-висцеральных феноменов. Основные из них и наиболее актуальные для детского возраста описываются в литературе под названиями снохождения и сноговорений, неожиданных беспричинных пробуждений и просоночных состояний, гипногогических иллюзий, ночных вздрагиваний и миоклоний, бруксизма, патологических привычных действий и стереотипий, ночной пароксизмальной мышечной дистонии [Lugaresi E., 1981], ночного энуреза, разнообразных пароксизмальных феноменов со стороны сердечно-сосудистой, дыхательной систем, желудочно-кишечного тракта и др.
Ряд исследователей обнаруживали парасомнии в анамнезе детей и взрослых больных эпилепсией, однако расценивали их отношение к этому заболеванию по разному. Так например, ряд авторов всегда и безусловно относили парасомнии к неэпилептическим ЦП [Ковалев В.В. и соавт. 1988; Schmitt J., 1979 и др.], другие – с не меньшим основанием считали их реальными факторами риска по эпилепсии [Асанова Л. М.-Б., 1990; Кельин Л.Л., 1990 и др.], отмечали учащение и клинический полиморфизм парасомний в период предшествующий развертыванию первого спонтанного ЭП [Болдырев А.И., 1990; Буздин В.В., 1980 и др.]. По данным последних авторов парасомнии встретились в качестве инициальных проявлений эпилепсии у детей в 32% наблюдений. Приведенные факты указывают не только на хорошо известные трудности дифференцирования неэпилептических парасомний и ЭП во сне, но и являются принципиально важными по двум соображениям: мы связываем их с определенной общностью неврологии всех ЦП, развертывающихся во сне и вероятной возможностью провоцирования у некоторых детей первых ЭП повторными неэпилептическими парасомниями.
В научной литературе не прекращается дискуссия по вопросу связи с эпилепсией многочисленных вегетативно-висцеральных пароксизмов. В частности до последнего времени ряд авторов продолжают выделять диэнцефальную (гипоталамическую) эпилепсию, проявляющуюся полисистемными вегетативными кризами, на высоте которых наступает кратковременное расстройство сознания, вплоть до его утраты, и возможны судороги [Громов С.А. и соавт., 1992]. В эксперименте показана возможность формирования эпилептического очага в области гипоталамуса [Макаридзе М.Г., Окуджава В.М., 1989] с независимым его функционированием от корковых эпилептических очагов [Voiculescu et al., 1980]. Другие авторы отрицают возможность первичного эпилептогенеза в области гипоталамуса, в связи с чем, по их мнению, все вегетативные ЭП могут иметь только корковое происхождение, а гипоталамус – лишь иногда вторично вовлекается в эпилептический разряд, пунктом отправления которого являются различные поля лимбической коры больших полушарий [Вейн А.М., Карлов В.А., 1980; Gastaut H., 1975].
Ряд авторов отмечают связь мигрени с эпилепсией. Приводятся данные о параллельном развертывании приступов мигрени и классифицируемых ЭП у одного больного [Вейн А.М., 1991; Федорова М.П., 1978]; некоторых больных, страдающих мигренозными приступами относят к группе риска по эпилепсии [Асанова Л.М.-Б., 1990; Geets W., 1972 и др]; на ЭЭГ больных мигренью нередко регистрируется пароксизмальная, в том числе и типичная эпилептическая активность [Пазюк Е.М., 1995; Gastaut S.L. et al., 1975], а нарушения психики у больных мигренью могут соответствовать таковым при эпилепсии [Свиридова Е.И. и соавт., 1986, 1990]. В исследованиях Л. М.-Б. Асановой [1990] у детей из семей родителей больных мигренью, эпилепсия отмечена в 21,4%, и неэпилептические ЦП – в 33% наблюдений. Наконец, некоторые авторы выделяют так называемые переходные варианты мигренозных цефалгий, которые при определенных патологических условиях, которые мы бы назвали факторами риска по эпилепсии, сменяются типичными, эпилептическими припадками [Panayiotopulos C.P., 1980; Whitti C.W., 1971].
Пароксизмальные боли в животе церебрального происхождения (абдоминалгии, абдоминальные кризы) встречаются более чем у 4% детей в популяции [Сараджишвили П.М., Геладзе Т.Ш., 1977]. Все они связываются с органической патологией глубинных структур мозга и могут иметь как эпилептическую так и неэпилептическую природу. С 1969 г. эпигастральные и абдоминальные припадки выделяются в качестве самостоятельных рубрик в международной классификации эпилептических припадков [Gastaut H., 1975]. Группу пароксизмальных абдоминалгий, характерных для детского возраста выделил А.М. Вейн [1991]: абдоминалгии психогенной природы, абдоминальную мигрень, абдоминальную форму тетании, абдоминальные боли при гипервентеляционном синдроме и при периодической болезни.
Задачи настоящего издания не позволяют обойти вниманием факты наличия пароксизмальных абдоминалгий у детей и взрослых в преморбидном периоде эпилепсии, и в качестве начальных проявлений этого заболевания [Болдырев А.И., 1990; Сараджишвили П.М., Геладзе Т.Ш., 1977; Харитонов Р.А. и соавт. 1989 и др.]. Например, по данным П.М. Сараджишвили, Т.Ш. Геладзе [1977] абдоминальные, либо эпигастральные кризы развертывались в качестве первых проявлений эпилепсии у 6,8% больных до 20 летнего возраста, что в несколько раз превосходит частоту подобных приступов в раннем анамнезе лиц здоровой популяции. Более чем у половины этих больных пароксизмальные абдоминалгии сочетались с другими ЦП, характерными для детского возраста – фебрильными припадками, парасомниями и др., что совпадает с исследованиями и других авторов [Гузева В.И., 1992; Кельин Л.Л., 1990]. У всех больных выявлены указания на конкретные этиологические факторы (органическое повреждение мозга, полученное в период беременности и родов, нейроинфекции) и однотипные с эпилепсией патологические изменения на ЭЭГ.
В целом, все обсужденные выше ЦП объединяет, как правило, общая экзогенная обусловленность, нередко сочетающаяся с идентичной наследственностью по соответствующим ЦП и по эпилепсии. Резонно предположить, что общность этиологии и топического диагноза лежит в основе и патогенетического сходства всех или многих ЦП, подтверждаемого результатами ЭЭГ исследований. Это отчасти объясняет очевидные клинические факты преемственной связи между детскими ЦП и развивающейся в последующем эпилепсией. Становятся более понятными трудности при первичной диагностике эпилепсии и ее дифференцировании с другими классами заболеваний, в клинике которых имеют место неэпилептические ЦП, и частое наличие последних в анамнезе больных эпилепсией и идентификация их не только в качестве факторов риска, но и манифестных проявлений данного заболевания.
Таким образом, в литературе накоплены лишь разрозненные сведения о преморбидном состоянии детей больных эпилепсией и начальных проявлениях этого заболевания, протекающих главным образом пароксизмально, что подтверждалось порою и данными ЭЭГ. Отдельные авторы эмпирически, следуя лишь клинической логике пытались проводить некоторым из этих детей антиконвульсантную терапию с профилактической целью, прогнозируя у них развитие эпилепсии в будущем [Болдырев А.И., 1988; Кельин Л.Л., 1990; Eadie M.J., 1983; Nelson K.B., 1986]. Однако до настоящего времени учение о донозологическом периоде эпилепсии, как облигатном этапе эпилептогенеза у всех больных эпилепсией, основанное на комплексном исследовании клинических проявлений этого периода, этиологии, патофизиологии и средней продолжительности, так и не было создано. Вот почему современная врачебная тактика при церебральных и особенно первых пароксизмах у детей все еще полна грубых ошибок, а о широком применении планового, научно обоснованного превентивного антиэпилептического лечения с включением АЭП на постоянной основе – все еще не идет и речи.
1.3. Манифестные проявления эпилепсии у детей. Критерии диагностики заболевания.
Эпилепсия в стадии своих развернутых проявлений представляет собой органическое заболевание мозга полиэтиологической и полипатогенетической природы с хроническим течением и преимущественным началом в детском возрасте. Главным клиническим проявлением заболевания являются повторные, спонтанные эпилептические припадки судорожного или бессудорожного характера, развертывающиеся на фоне утраченного, либо измененного и реже сохраненного сознания. В основе эпилептического припадка лежит чрезмерный, гиперсинхронный разряд популяции невронов предпочтительно корковой локализации, распространяющийся на весь мозг, либо на одну или несколько его функциональных систем, а также нейромышечную и нейровисцеральную периферию. Нередко эпилепсия принимает прогрессирующее течение и сопровождается у таких больных нарушениями психики. Данное определение является созвучным с таковым, одобренным комитетом экспертов ВОЗ по эпилепсии [Gastaut H., 1975] и с определениями, предложенными другими авторами [Гусев Е.И., Бурд Г.С., 1994; Сараджишвили П.М., Геладзе Т.Ш., 1977; Wolf P., 1984 и др.].
В этиологии эпилепсии выделяют две основные группы причин: наследственные факторы и органические повреждения мозга. Следует подчеркнуть, что наследственные факторы играют определенную роль лишь при некоторых формах заболевания, в части семей популяции, но не у всех больных эпилепсией. Различают два основных механизма проявления наследственного фактора в эпилепсии: моногенное наследование заболевания и наследование предрасположенности к нему. К настоящему времени идентифицировано лишь 11 локусов генов, контролирующих некоторые клинические формы эпилепсии преимущественно детского возраста, например, доброкачественную семейную эпилепсию новорожденных, абсансную эпилепсию (пикноэпилепсию), миоклоническую эпилепсию Янца и др. Однако, параллельно и немедленно выяснилось, что даже эти немногочисленные чисто наследственные формы эпилепсии оказались этиологически гетерогенными, и во многих семьях развивались без обнаруженных в других семьях локусов генов.
Полигенное наследование предрасположения к эпилепсии состоит в передаче определенной совокупности конституциональных факторов в ряде семей популяции. Оно проявляется особым, пароксизмальным типом реагирования мозга в ответ на возмущения гомеостаза факторами среды и имеет, таким образом, предпочтительно патогенетическое, нежели прямое этиологическое значение. Полигенное наследование предрасположенности к заболеванию при решающем воздействии на его проявление факторов среды, соответствует критериям мультифакториальных заболеваний, к которым относят и эпилепсию [Lanz D. et al., 1986].
Органическое повреждение мозга по общепринятому мнению является основной и самой частой причиной эпилепсии, причем у детей мозг повреждается, главным образом, в период беременности и родов, посредством воздействия на организм матери и мозг ребенка многочисленных патологических факторов, которых насчитывают несколько десятков. Кроме традиционных факторов риска по эпилепсии, таких как асфиксия, внутричерепная родовая травма, угроза прерывания беременности и др., вызывающих клинически очерченные варианты пре- и перинатальной энцефалопатии, в настоящее время большое значение в этиологии эпилепсии придается и субклиническим повреждениям мозга. Установлено в частности, что аномальная нейрональная миграция, начинающаяся уже на 8 неделе гестации приводит к эктопии коркового вещества, микродисплазии и гетерогенезу коры больших полушарий. Эти участки локальной корковой микродисплазии могут быть настолько малы, что далеко не всегда фиксируются компьютерной томографией, однако доказано, что именно они могут быть источниками эпилептогенеза [Гусев Е.И., Бурд. Г.С., 1994; Coc Ch.J., 1989]. Исключительно важная роль органических повреждений мозга в происхождении эпилепсии подчеркивается некоторыми авторами в определении заболевания. Так, например, видный отечественный эпилептолог А.И. Болдырев [1984] определяет эпилепсию как «вторую болезнь, развивающуюся в стадии резидуальных явлений органического повреждения мозга».
В наших собственных наблюдениях, на материале 460 детей больных эпилепсией, основным этиологическим фактором заболевания являлось органическое повреждение мозга, выявленное в анамнезе 82% больных, причем у 62,9% из них оно было получено в периоде беременности и родов и идентифицировано в качестве клинических вариантов пре- перинатальной энцефалопатии по данным истории развития ребенка и у 19% больных – перенесено в постнатальном периоде.
В соматическом статусе обращали на себя внимание разнообразные малые аномалии развития. Они обнаружены в количестве 5 и более у 95% больных и косвенно указывали на возможность малого дисэмбриогенеза мозга.
При объективном неврологическом исследовании очаговые неврологические симптомы обнаружены у всех больных. В 80% наблюдений они были немногочисленны, носили рассеянный двухсторонний характер и в 20% – составили легко выраженные неврологические синдромы – негрубые гемипарезы, нарушения равновесия и координации движений, черепной иннервации, функции речи. Дополнительными методами исследования органическая природа заболевания подтверждена у 66% больных. Речь шла чаще всего о рентгенологических признаках внутричерепной гипертензии, гидроцефалии и изменениях контуров боковых и третьего желудочков мозга, локальном или диффузном расширении подоболочечных пространств, косвенно свидетельствовавших о явлениях атрофии вещества больших полушарий.
У 34% больных органическое повреждение мозга сочеталось с наследственным фактором, который был представлен осложнением семейного анамнеза по эпилепсии (14%) и по другим ЦП – (20%).
У 18% больных этиология заболевания не была выявлена с определенностью, однако, косвенные признаки указывающие на возможность перенесенного органического повреждения мозга были и у этих больных. Они состояли в наличии рассеянной очаговой неврологической симптоматики, 5 и более малых аномалий развития, общих инфекционных заболеваний и ушибов головы в анамнезе, оценке общего состояния по шкала Апгар при рождении ребенка в 7-8 баллов и др.
Эпилепсия является также полипатогенетическим заболеванием. Общими патогенетическими факторами ЭП являются эпилептический очаг, эпилептическая готовность мозга и пусковой фактор. Весьма схематизированные представления о патогенезе заболевания в целом, и особенно в случаях прогрессирующего течения, предполагают последовательную цепь патофизиологических явлений: эпилептический неврон- – эпилептический очаг – эпилептическая система – эпилептический мозг. Перечисленные понятия являются преимущественно нейрофизиологическими категориями, однако в формировании каждого из них принимают участие и многие другие факторы в качестве самостоятельных звеньев патогенеза: эндокринные, иммунологические, нейрохимические, возрастные, генетические и др. В целом, традиционная на сегодня схема патогенеза ЭП и эпилепсии представляет собой лишь конечный результат сложного, динамического взаимодействия индивидуальной для каждого больного констелляции интимных процессов, развертывающихся на молекулярном, внутриклеточном, межнейрональном, системном и организменном уровнях и подлежащих дальнейшему изучению.
История создания классификации эпилепсии отражает как естественные трудности этого процесса, так и последовательное применение ее ведущих принципов: этиологического, патогенетического, топографо-анатомического и клинического.
По этиологическому принципу в течении продолжительного времени выделяли две формы эпилепсии: симптоматическую, вызванную экзогенным повреждением мозга и генуинную, к которой относили все формы заболевания не связанные с явным органическим повреждением мозга. Другую разновидность классификации заболевания по этиологическому принципу предложил J. Bancaud [1976], выделивший функциональные и органические эпилепсии. К функциональным автор отнес формы вызванные наследственными, метаболическими и эндокринными факторами, а к органическим – эпилепсии связанные с органическими поражениями мозга инфекционной, травматической, токсической, сосудистой этиологии и др.
Классификацию эпилепсии по патогенетическому принципу разработал F. Servit [1963]. В ее основе лежит различное сочетание трех факторов: эпилептической готовности мозга, эпилептического очага и внешнего раздражителя. В зависимости от преобладания того или иного фактора в патогенезе припадков автор выделил три формы эпилепсии: первичную, фокальную и рефлекторную.
Топографо-анатомический принцип основан на локализации эпилептического очага в мозге и находит отражение в соответствующих терминах: лобная, височная, теменная, затылочная, лимбическая, роландическая эпилепсия и др.
Клинический принцип классификации отражает клинику и название припадка в соответствии с классификацией, наличие обострений и ремиссий, характер и степень нарушения психики, течение заболевания.
Некоторые авторы классифицируют эпилепсию по возрастному признаку, выделяя при этом эпилепсию новорожденных, эпилепсию детского возраста, эпилепсию взрослых и старческого возраста.
Многообразие принципов классификации отразилось и на терминологии. Так, например, ряд зарубежных авторов для обозначения различных форм заболевания применяют множественное число – «эпилепсии» [Aird R.W., 1984; Bancaud J., 1976; Gastaut H., 1970; Matthes. A., 1984 и др.]. Другие зарубежные авторы и отечественные эпилептологи, включая и автора настоящего издания говорят об эпилепсии как о единой болезни, имеющей большое количество этиологических, топографо-анатомических, клинических и возрастных вариантов заболевания [Болдырев А.И., 1990; Карлов В.А., 1990; Majkowski J., 1979,1986; Wolf P., 1984 и др.].
Комплексную классификацию, основанную на этиологическом, патофизиологическом и клиническом принципах разработал Gastaut H. [1969]. Автор выделил три группы эпилепсий: парциальные, первично-генерализованные и вторично-генерализованные. Каждой из них соответствуют основные признаки заболевания: этиология, данные неврологического исследования, клиника припадков, возраст начала заболевания и данные ЭЭГ. Последняя международная классификация эпилепсии 1989 года основана также на двух известных принципах: этиологическом и патофизиологическом [Бурд Г.С., 1995; Roger J. et al., 1992]. По этиологическому принципу выделена симптоматическая, идиопатическая и криптогенная эпилепсия. Симптоматическая эпилепсия вызвана известными или предполагаемыми органическими повреждениями мозга. В происхождении идиопатической эпилепсии главное значение придается предполагаемой наследственной предрасположенности. Криптогенная эпилепсия (болезнь с не установленной, скрытой причиной) более тяготеет к симптоматической эпилепсии, с невыясненной однако этиологией. На основе патофизиологического принципа классификация выделяет генерализованную эпилепсию и эпилепсию с определенной локализацией эпилептического очага. В целом классификация содержит 4 номинации, первые две из которых предусматривают выделение идиопатических, симптоматических и криптогенных форм, связанных или не связанных с возрастом.
Эпилепсия и эпилептические синдромы связанные с определенной локализацией эпилептического очага (фокальная, локальная, парциальная эпилепсия).
Генерализованная эпилепсия и эпилептические синдромы.
Эпилепсия и эпилептические синдромы, которые не могут быть отнесены к фокальным или генерализованным.
Специальные синдромы, в качестве примеров которых названы фебрильные припадки и ЦП, развивающиеся при нарушениях обмена или токсических состояниях, обусловленных, например, приемом алкоголя, лекарствами, эклампсией и др.
Диагностика эпилепсии в развернутой стадии заболевания и особенно при прогрессирующем течении производится уверенно и базируется на сочетании трех ведущих синдромов: повторных, спонтанных ЭП, нарушений психики и эпилептической активности на ЭЭГ. Важным этапом формулирования диагноза эпилепсии является идентификация ЭП согласно рекомендациям ВОЗ.
Международная классификация эпилептических припадков 1981 года.
I. Парциальные (фокальные, локальные) припадки
А. Простые парциальные припадки (протекающие с сохранением сознания).
1. Моторные припадки:
-фокальные моторные без марша
-фокальные моторные с маршем
-адверсивные
-постуральные
-фонаторные
2. Сенсорные припадки:
-соматосенсорные
-зрительные
-слуховые
-обонятельные
-вкусовые
-с головокружением
Припадки с вегетативно-висцеральными проявлениями
Припадки с нарушением психических функций
-дисфазические
-дисмнестические
-с нарушениями мышления
-эмоционально-аффективные
-с иллюзиями
-со сложными галлюцинациями
Б. Комплексные парциальные припадки (протекающие с нарушением сознания)
1. Начало с простых парциальных припадков с последующим нарушением сознания:
-начало с простого парциального припадка с последующим нарушением сознания
-начало с простого парциального припадка с последующим нарушением сознания и двигательными автоматизмами
2. Начало с нарушения сознания:
-припадки только нарушенного сознания (псевдоабсансы)
-припадки нарушенного сознания с двигательными автоматизмами
В. Парциальные припадки с вторичной генерализацией.
1.Простые парциальные припадки (А), ведущие к генерализованным судорожным припадкам
2.Комплексные парциальные припадки (Б), ведущие к генерализованным судорожным припадкам
3.Простые парциальные припадки, переходящие в комплексные парциальные припадки с последующим возникновением генерализованных судорожных припадков
II. Генерализованные припадки
А. Абсансы
1. Типичные:
-только с нарушением сознания
-с легким клоническим компонентом
-с тоническим компонентом
-с автоматизмами
-с вегетативным компонентом
2. Атипичные абсансы:
-изменения мышечного тонуса более выражены, чем при типичных абсансах
-начало и (или) прекращение припадков происходит не внезапно, а постепенно.
Б. Миоклонические припадки
В. Клонические припадки
Г. Тонические
Д. Тонико-клонические припадки («grand mal»)
Е. Атонические (астатические) припадки
III. Неклассифицируемые эпилептические припадки.
Приложение
Повторные эпилептические припадки могут происходить при различных обстоятельствах:
1. Случайные эпилептические припадки, наступающие неожиданно и без провоцирующих факторов.
2. Циклические эпилептические припадки, возникающие через более или менее регулярные интервалы времени (в связи с циклом сон-бодрствование, с определенными фазами овариально-менструального цикла и др.)
3. Приступы вызванные:
-несенсорными факторами (усталость, алкоголь, эмоциональный стресс и др.)
-сенсорными факторами («рефлекторные» эпилептические припадки)
4. Длительно существующие или часто повторяющиеся эпилептические припадки (эпилептический статус).
Клиническая картина и топико-диагностическое значение основных классифицированных к настоящему времени парциальных и генерализованных ЭП достаточно полно изложено в современной литературе, в том числе и в руководстве автора [Миридонов В.Т., 1994]. В наших собственных наблюдениях эпилепсия проявлялась только генерализованными припадками у 76,4% больных, только парциальными припадками – у 9,3%, генерализованными и парциальными припадками у 14,3% больных.
Для настоящего издания очень важно специально отметить, что в повседневной практике далеко не каждая клиническая ситуация, содержащая единичные или даже повторные эпилептические припадки, влечет за собой постановку диагноза эпилепсии. Терминологический словарь по эпилепсии предусматривает соответствующий перечень патологических состояний, содержащих эпилептические припадки в качестве своих клинических проявлений.
1. Единичные спонтанные эпилептические припадки, развертывающиеся неожиданно и без провоцирующих факторов. По данным W.A. Hauser (1994) количество детей, перенесших в своей жизни один подобный припадок на порядок превышает количество детей, больных собственно эпилепсией. При повторном развертывании спонтанных эпилептических припадков диагноз эпилепсии становится весьма вероятным.
2. Эпилептическая реакция. Представляет собой обычно генерализованный, судорожный чаще единичный и реже повторный вызванный эпилептический припадок. Средовый фактор непосредственно спровоцировавший приступ является чрезвычайно сильным, например острая алкогольная и другие интоксикации, гипертермия, асфиксия, электротравма, гипогликемия, насильственное лишение сна и др. В международной классификации эпилепсии (1989 г.) эпилептическая реакция учтена в группе специальных синдромов под названием эпилептических припадков, связанных с определенной ситуацией. У детей, перенесших эпилептические реакции, особенно при повторном их развертывании, значительно чаще, чем в среднем в детской популяции, появляются первые спонтанные эпилептические припадки и обнаруживается склонность к их последующему рецидивированию, т.е. к заболеванию эпилепсией. Собственно же эпилептическая реакция, даже после повторного развертывания, не дает оснований диагностировать эпилепсию.
Эпилептический синдром терминологическим словарем по эпилепсии определяется как синдром эпилептических припадков при текущем органическом заболевании мозга в его остром, раннем и позднем восстановительном периоде – энцефалите, черепно-мозговой травме, перинатальной энцефалопатии и др. Эпилептический синдром дебютирует развернутыми, классифицируемыми, мономорфными, чаще парциальными и вторично-генерализованными припадками и реже приступами типа «grand mal». Абсансы не характерны. Припадки носят спонтанный и нередко повторный характер. В постприступном состоянии может быть весьма стойкий очаговый неврологический дефицит. Объективное неврологическое и дополнительные методы исследования обнаруживают признаки текущего очагового органического повреждения головного мозга. Эпилептическая активность на ЭЭГ у этих больных не является строго обязательной, а изменения психики не носят специфического эпилептического характера и обусловлены основным патологическим процессом. С этих позиций повторные спонтанные эпилептические припадки, развертывающиеся в периоде резидуальных явлений органического заболевания мозга должны расцениваться в качестве эпилепсии. Однако, в каждом подобном случае вопрос формулирования диагноза решается индивидуально и с исключениями из общего правила. Например, при исходе перинатальной энцефалопатии в детский церебральный паралич с редкими эпилептическими припадками, последние чаще обозначаются в качестве эпилептического синдрома при сохранении основного клинического диагноза детский церебральный паралич. Кроме того, в определенных ситуациях и частые эпилептические припадки развертывающиеся в течении многих лет допустимо рубрифицировать в качестве эпилептического синдрома. Так, классификация эпилепсии 1989 г. в группе генерализованной симптоматической эпилепсии предусматривает выделение специфических синдромов. Речь идет о наследственных заболеваниях и врожденных аномалиях мозга, в клинической картине которых эпилептические припадки могут даже доминировать- миоклонус- эпилепсии, факоматозах, синдроме Айкарди, лиссэнцефалии- пахигирии и др.
Эпилепсия или эпилептическая болезнь.
Чаще всего развивается в резидуальном периоде явных (симптоматическая форма) органических повреждений мозга. При идиопатической форме явных причин заболевания не выявляется, за исключением предполагаемой наследственной предрасположенности Характеризуется повторными спонтанными припадками, пароксизмальной эпилептической активностью на ЭЭГ и при прогрессирующем течении заболевания- выраженными нарушениями психики. В основе патофизиологии заболевания лежит классическое сочетание трех факторов: постоянно действующего эпилептического очага, эпилептической готовности мозга и слабо выраженного, часто незаметного пускового фактора, что создает впечатление спонтанности, аутохтонности ЭП. Нередки феномены клинического полиморфизма припадков и трансформации их с течением времени. Чаще других имеют место абсансы, генерализованные тонико-клонические припадки и парциальные припадки с быстрой вторичной локализацией. Выход из припадка более быстрый и полный, чем при эпилептическом синдроме. При объективном неврологическом исследовании часто не определяется выраженных очаговых симптомов, свидетельствующих о заметном повреждении специфических систем мозга. Более характерны симптомы дисфункции неспецифических систем мозга- нарушения сна и бодрствования, вегетативной функции, модально неспецифической памяти, эмоционального поведения и др. Большинство больных рождаются в условиях действия различных сочетаний факторов риска по пре- перинатальной органической патологии мозга и меньшая часть- с диагностированными вариантами перинатальной энцефалопатии легкой степени с практическим выздоровлением к концу первого года жизни. Однако в преморбидном периоде у большинства таких детей и подростков также выявляются клинически очерченные признаки патологии глубинных структур мозга- синдром повышенной нервно-рефлекторной возбудимости в неонатальном периоде, синдром врожденной детской нервности, невропатии, школьной дезадаптации, гиперактивного поведения, адипозного статуса, вегетативной дистонии и др. Около трети больных в период предшествующий развертыванию первого эпилептического припадка страдают повторными неэпилептическими церебральными пароксизмами, и их наследственный анамнез нередко оказывается осложненным по эпилепсии и другим церебральным пароксизмам [Миридонов В.Т., 1996].
Нарушения психики у детей больных эпилепсией касаются как личности в целом, так и многих отдельных сторон психической деятельности: интеллекта, памяти, мышления, эмоциональной сферы, поведения и черт характера. Они могут быть пароксизмальными, периодическими и перманентными.
Пароксизмальные нарушения тесно связанны непосредственно с эпилептическими припадками и составляют при этом либо основу их семиологии, либо проявляются в определенной фазе припадка, либо в послеприступном состоянии. Частота этих нарушений обычно не приводится в литературе, однако вероятно, что они имеются у большинства больных эпилепсией, кроме наблюдений с некоторыми вариантами простых парциальных припадков.
Нарушения психики периодического характера встречается значительно реже. У детей больных эпилепсией их наблюдают с частотой от 3% до 50%. К периодическим нарушениям психики относятся дистимии, дисфории и психозы. Последние относятся к компетенции психиатра и описаны в соответствующей литературе [Абрамович Г.А., Харитонов Р.А., 1979 и др.]. В настоящем издании, ограниченном преимущественно неврологическими аспектами эпилепсии, можно лишь отметить, что эпилептические психозы встречаются у меньшинства больных, клинические проявления их весьма разнообразны - от ипохондричности, переживания тревоги и страха – до психомоторного возбуждения, агрессивности и импульсивного нелепого поведения. Они могут продолжаться от нескольких часов до нескольких дней и недель.
Среди перманентных нарушений психики традиционно выделяют специфические (типичные для эпилепсии) и неспецифические (нетипичные). Типичные перманентные нарушения психики у детей обнаруживают в среднем у 20% больных, нетипичные (невротического, неврозоподобного типа) – у 40%, глубокое и тотальное нарушение всех психических функций- до 15% и полную сохранность психических функций- до 25% больных.
При прогрессирующем течении заболевания нарушения психики специфического типа могут быть представлены тремя основными синдромами: эмоционально-волевыми нарушениями, интелектуально-мнестическими расстройствами и специфическими изменениями личности, которые профессионально и наиболее полно излагаются в соответствующих руководствах по психиатрии и по эпилепсии у взрослых.
У детей больных эпилепсией изменения психики становятся сравнимыми с названными выше преимущественно со школьного возраста, а в дошкольном и раннем возрасте их выявить труднее. Чаще у таких больных имеет место задержка, остановка или регресс психомоторного развития.
Нельзя однако не отметить, что еще в 1975 году комитет экспертов ВОЗ по эпилепсии подверг сомнению факт специфичности данных нарушений психики только для эпилепсии, дезавуировал и не рекомендовал к применению термины «эпилептическая», «эпилептоидная» личность, «эпилептическое поведение», «эпилептическая конституция». Оказалось, что изменения психики, ранее считавшиеся специфическими для эпилепсии наблюдаются и при других заболеваниях мозга, и не только при эпилептических припадках, но и без таковых. В настоящее время расстройства психики у больных эпилепсией рассматриваются как самостоятельный синдром, выраженность которого обусловлена рядом факторов: локализацией и распространенностью эпилептогенного очага, возрастом начала и продолжительностью заболевания, характером и частотой припадков, наследственным фактором, особенностями преморбидного состояния психики, условиями воспитания и др.
У 40% детей больных эпилепсией перманентные нарушения психики носят неспецифический характер. В поведении этих детей господствуют две тенденции. Так, у части больных доминируют астенические проявления. Дети жалуются на повышенную утомляемость при обычных нагрузках, головные боли, нарушения сна. В поведении отмечаются полярность эмоций, необоснованное упрямство, плаксивость и пр. У других больных преобладает психомоторная расторможенность, гиперактивность, непоседливость, трудная управляемость поведением, отсутствие дневного засыпания с раннего возраста и др.
На материале собственных наблюдений изменения психики специфического характера, сравнимые с таковыми у взрослых больных эпилепсией выявлены у 20% больных, нарушения поведения и психики невротического типа – у 52%, задержка психического развития имела место у 6% и у 22% больных эпилепсией состояние психики соответствовало возрасту здорового ребенка.
В течение последних десятилетий ЭЭГ прочно заняла свое место в дифференциальной диагностике ЦП и позитивной диагностике эпилепсии. Обычно у данных больных регистрируются три группы патологических ЭЭГ изменений: эпилептическая активность, условно-эпилептическая активность и дизритмия.
Эпилептическая активность (типичная эпилептическая активность, конвульсивная, судорожная активность) включает в себя характерные для эпилепсии (специфические) графоэлементы, появляющиеся пароксизмально: пики или спайки, полипики, острые волны, а также комплексные графоэлементы: пик-волна, полипик-волна, острая волна-медленная волна, множественные пики с последующей группой медленных волн.
Условно-эпилептическую активность, расцениваемую также в качестве признаков снижения порога судорожной готовности мозга или просто повышенной судорожной готовности мозга, представляют следующие графоэлементы: гиперсинхронный, заостренный по форме альфа-ритм, гиперсинхронный бета-ритм, и пароксизмальные разряды высоко амплитудных волн альфа-, бета-, тета- или дельта диапазона.
Дизритмия представляет собой комплекс разнообразных нарушений нормальных компонентов ЭЭГ и патологических изменений. Сочетает в себе ЭЭГ признаки органического повреждения преимущественно неспецифических систем мозга (лимбической коры, диэнцефалона, ретикулярной формации ствола мозга) и признаки функциональной незрелости мозга. Нередко констатируется в качестве общемозговых, пограничных ЭЭГ изменений. К проявлениям дизритмии относят асимметрию и нарушение синфазности потенциалов полушарий мозга, нарушение нормального топографо-анатомического распределения основных ЭЭГ ритмов, слабую реактивность на функциональные пробы, недоразвитие основного ритма («осколки» альфа ритма), запаздывание возрастных зональных различий, появление постоянной медленной (тета-, дельта-, сочетание тета- и дельта активности), регистрируемой в отведениях от средних и передних отделов больших полушарий, появление полифазных потенциалов и др. В настоящее время дизритмия на ЭЭГ детей и подростков больных эпилепсией расценивается как фон, на котором регистрируются основные элементы эпилептической активности. Происхождение дизритмии связывают с воздействием на электрогенез мозга ряда факторов: органических повреждений чаще пре-, перинатального, реже постнатального происхождения и локализованных преимущественно в неспецифических его системах, недоношенности, наследственных, конституциональных и возрастных факторов, а также эпилептического процесса.
Эпилептическая активность на ЭЭГ не является облигатным признаком эпилепсии во всех наблюдениях и особенно при однократном исследовании в покое и при традиционных функциональных пробах с поверхностной (скальповой) регистрацией потенциалов. Количество ЭЭГ позитивных вариантов заболевания колеблется от 60% до 95%. Особенно заметным является «отставание» специфических ЭЭГ изменений от клиники эпилепсии в детском возрасте.
Для повышения информативности ЭЭГ исследования и увеличения его диагностических возможностей используется регистрация ЭЭГ во время приступа, интрацеребральная ЭЭГ (электрокортикография, электросубкортикография, стереоэкстроэнцефалография), а также методики регистрации вызванных потенциалов, раздельного и одновременного ЭЭГ и видео мониторинга припадков и межприступного состояния.
Среди проверенных временем, а также новых дополнительных методов исследований больных эпилепсией широко применяются обзорная краниография, эхоэнцефалоскопия, компьютерная позитронная и ядерно-магнитно-резонансная томография черепа и мозга, широкий спектр биохимических методов исследования, например с целью определения спектра и количественного содержания в крови естественных про- и антиэпилептических метаболитов и др.
Однако главным содержанием заболевания является синдром повторных припадков. Эксперты ВОЗ подчеркивают неправомочность диагноза эпилепсии при наличии психических нарушений и специфических патологических ЭЭГ изменений без клинической констатации эпилептических припадков. Поэтому основным разрешительным критерием диагноза являются повторно развивающиеся спонтанные эпилептические припадки, а конкретные модели формирования эпилептической болезни схематически могут быть обозначены так: эпилептическая реакция (реакции) – эпилепсия; эпилептический синдром – эпилепсия; спонтанные эпилептические припадки на фоне наследственного анамнеза, осложненного по эпилепсии – эпилепсия; спонтанные эпилептические припадки невыясненной причины – эпилепсия. В связи с этим в своей практической деятельности мы руководствуемся аксиомой: не может быть и речи о постановке диагноза эпилепсии при констатации единственного эпилептического припадка вне зависимости от условий его развертывания и идентификации в качестве эпилептической реакции, эпилептического синдрома или спонтанного припадка. В то же время ни терминологический словарь по эпилепсии, ни известные международные классификации этого заболевания не называют количество спонтанных припадков в качестве пороговой величины, по достижении которой следует диагностировать эпилепсию. Отдельные авторы также нечасто называют эту пороговую величину, однако подобные данные в литературе все-таки есть. Так например, Л.Л. Кельин (1990) обозначает ее в количестве двух несимптоматических эпилептических припадков, А.Ю. Ратнер (1989)- двух-трех, а J.Cavazzuti (1980)- двух не лихорадочных и несимптоматических припадков в течении 5 лет.
Для нас эта пороговая величина также составляет 2-3 спонтанных припадка, развернувшихся на протяжении одного возрастного периода детства, продолжительность которого в свою очередь, не должна составлять более 5 лет. После второго спонтанного, классифицируемого ЭП мы ставим диагноз эпилепсии при наличии хотя бы одного из следующих условий: эпилептической реакции (реакций) в анамнезе, предшествующего спонтанным припадкам эпилептического синдрома (эпилептические припадки на фоне текущего органического заболевания мозга в остром, раннем восстановительном и позднем восстановительном периодах), эпилептической активности на ЭЭГ, наследственного анамнеза, осложненного по эпилепсии, грубого очагового неврологического дефицита, выявленного при объективном обследовании. Если же перечисленных факторов у больного не было и нет, то диагноз эпилепсии становится предпочтительным лишь после третьего спонтанного припадка.
ГЛАВА 2. КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА ДОНОЗОЛОГИЧЕСКОГО ПЕРИОДА ЭПИЛЕПСИИ У ДЕТЕЙ
2.1. Эпилептические припадки в донозологическом периоде
эпилепсии у детей.
Донозологический период эпилепсии мы представляем как процесс становления заболевания от первых ЦП до манифестных проявлений, достигающих такой степени выраженности, которая позволяет обоснованно диагностировать у ребенка столь тяжелое в клиническом и социальном плане заболевание, каковым мы считаем эпилепсию. С момента постановки этого диагноза, процесс формирования эпилепсии считали завершенным, что одновременно означало и окончание донозологического периода заболевания.
При определении диагностических критериев эпилепсии руководствовались определением заболевания, приведенным в предыдущей главе и соответствующим по своим основным позициям рекомендациям ВОЗ. В соответствии с этим определением основным клиническим проявлением донозологического периода заболевания мы считали пароксизмальный синдром, динамику которого исследовали по данным анамнеза у больных с бесспорным диагнозом эпилепсии. В связи с тем, что донозологический период заболевания в этих наблюдениях был закончен, состояние психики и ЭЭГ изменения в соответствии с задачами настоящего издания исследовали у больных с отклоненным в процессе дифференцирования заболевания диагнозом эпилепсии, но страдавших церебральными пароксизмами и являвшихся носителями опасных сочетаний значимых факторов риска по эпилепсии. Эти больные расценивались как находящиеся в донозологическом периоде заболевания. Если у них выявлялись нарушения психики, то последние дополняли основное клиническое содержание заболевания. Патологические ЭЭГ изменения у этих больных подвергалось анамнезу в двух направлениях: во-первых, их идентифицировали в качестве фактора риска по эпилепсии высокой значимости и использовали в процессе прогнозирования развития заболевания и формирования группы риска; во-вторых, эти ЭЭГ находки привлекались для понимания и объяснения основ патофизиологии донозологических проявлений эпилепсии у детей.
При исследовании личного пароксизмального анамнеза больных эпилепсией мы обнаружили две господствующие тенденции. Первая из них состояла в том, что у части больных эпилепсия начиналась типичными эпилептическими припадками, как правило классифицируемыми и имеющими склонность к повторению, причем продолжительность светлого периода между первым и вторым, первым и третьим припадками колебалась от нескольких дней до нескольких лет и в большинстве наблюдений составляла 0,5-1,5 года. Вторая тенденция предполагала появление первого ЭП после определенного периода, содержанием которого являлись различные заболевания и патологические состояния, с разнообразными повторно развертывавшимися и атипично протекающими неэпилептическими пароксизмами. Период времени между первыми неэпилептическими пароксизмами и первым ЭП оказался более продолжительным и составлял у большинства больных 1,5-2,5 года.
В соответствии с выявленными тенденциями наметились два основных клинических варианта формирования эпилепсии у детей и соответствующая им средняя продолжительность донозологического периода заболевания. Первый вариант являлся традиционным и несколько укороченным по времени по сравнению со вторым, более продолжительным, при котором на смену атипично протекающим неэпилептическим пароксизмам приходили первые эпилептические припадки, имевшие склонность к сравнительно быстрому рецидиву. Традиционному варианту соответствовали 66% наблюдений, а формированию эпилепсии через стадию неэпилептических пароксизмов - 34%. Клиническая структура и удельный вес первых ЦП у детей больных эпилепсией представлен на рисунке 3 и таблицах 4 и 5.
Клинический анализ условий и обстоятельств развертывания первых эпилептических припадков у больных эпилепсией показал их неоднородность. У одних больных появление первого припадка связывалось с эпизодическим
воздействием хорошо известных провоцирующих факторов чрезвычайно выраженных по своей интенсивности; у других - первые припадки протекали на фоне уверенно идентифицированного текущего органического заболевания мозга, а у третьих - общим признаком оказалось отсутствие каких-либо очевидных факторов, спровоцировавших первый эпилептический припадок. Поэтому в настоящем исследовании, в соответствии с представлениями, господствующими в современной практической эпилептологии мы выделили три клинических варианта донозологического периода заболевания, основным содержанием которых являлись эпилептические припадки: эпилептическую реакцию, эпилептический синдром и спонтанные (неспровоцированные) эпилептические припадки.
Эпилептическую реакцию мы представляли себе как первый в жизни ребенка чаще всего генерализованный судорожный припадок в ответ на воздействие провоцирующего фактора чрезвычайной силы. В известной мере, она является стандартной реакцией мозга, предусмотренной в эволюционном ряду. Можно назвать и некоторые провоцирующие факторы, прогрессирующее воздействие которых может вызвать эпилептический припадок практически у каждого человека, например: асфиксия, электротравма и др. При исходно повышенном уровне пароксизмальной готовности мозга (приобретенном или унаследованным) и особенно у детей, эпилептическая реакция развивается предпочтительней, чаще и может быть повторной. Однако в целом, эпилептическая реакция является обратимым патологическим состоянием и в условиях исключения воздействия известного, а также и новых провоцирующих факторов, может никогда более не повториться.
В наших наблюдениях эпилептическая реакция обнаружена в анамнезе 111 больных эпилепсией, что составило 24% наблюдений первой группы. Основным провоцирующим фактором припадков являлась гипертермия, а господствующим клиническим вариантом – фебрильные припадки (86%): генерализованные судорожные 78% гемикорпоральные (гемиконвульсивные) - 6% и генерализованные атонические пароксизмы - 2%. Вторую и последующие
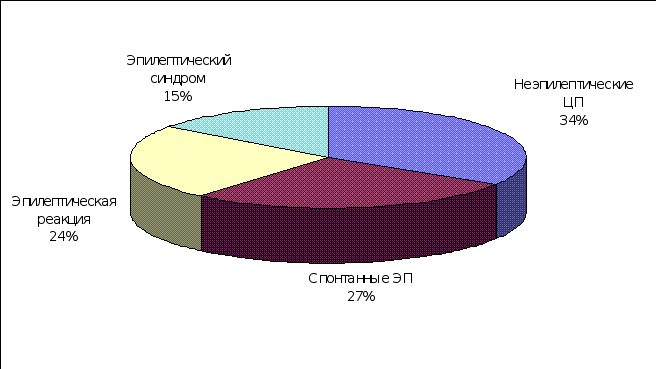
Рисунок 3. Клиническая структура и удельный вес первых ЦП у детей больных эпилепсией 460 больных (100% наблюдений)
Т аблица
4. Клиническая
структура и
количество
наблюдений
первых ЦП у
детей, больных
эпилепсией.
аблица
4. Клиническая
структура и
количество
наблюдений
первых ЦП у
детей, больных
эпилепсией.
|
№№ пп |
Рубрификация ЦП | Количество больных | % |
| 1 | Эпилептическая реакция | 111 | 24 |
| 2 | Эпилептический синдром | 69 | 15 |
| 3 | Спонтанные ЭП | 124 | 27 |
| 4 | Неэпилептические ЦП | 156 | 34 |
| 5 | Всего больных эпилепсией | 460 | 100 |
Таблица 5. Клиническая структура и количество наблюдений неэпилептических ЦП в анамнезе больных эпилепсией.
|
пп |
Название пароксизмов | Количество больных | % |
| 1 | Ночные страхи | 31 | 20 |
| 2 | Ночные миоклонии | 21 | 14 |
| 3 | Снохождения | 13 | 8 |
| 4 | Аффективно-респираторные припадки | 28 | 18 |
| 5 | Обмороки | 19 | 12 |
| 6 | Вегетативные пароксизмы | 9 | 6 |
| 7 | Метаболические пароксизмы | 5 | 3 |
| 8 | Сочетания пароксизмов | 30 | 19 |
| 9 | Всего | 156 | 100 |
по частоте позиции занимали асфиксия в родах (5%), ушибы головы в постнатальной жизни (3%) и депривация сна (2%). В качестве единичных провоцирующих факторов встречались алкогольная и медикаментозная интоксикации, продолжительный просмотр телепередач или игры с компьютером, электротравма. У 55 больных эпилептическая реакция развертывалась однократно и у 56 - повторно. Повторные эпилептические реакции наблюдались при гипертермии, ушибах головы и депривации сна. У больных судорожным синдромом периода новорожденности, вызванного асфиксией, кратность приступов выявить не удалось.
Интенсивность провоцирующих факторов оценивали следующим образом. Так, к гипертермии относили повышение температуры тела до 40 и выше. Асфиксию в родах констатировали на основе выписки из родильного отделения. В качестве эпилептической реакции расценивались приступы генерализованных судорог, развертывающихся в первые часы неонатального периода при условии отсутствия указаний на наличие очаговых неврологических синдромов. К ушибам головы относили травмы покровов мозговой части черепа без четких клинических указаний на черепно-мозговую травму.
Генерализованные судорожные припадки, характеризовавшие эпилептическую реакцию, носили тонико-клонический характер, и имели остальные типичные признаки большого судорожного эпилептического припадка типа «grand mal», за исключением двух больных с судорожными припадками при асфиксии в родах, у которых согласно данным выписки из родильного отделения, развивались генерализованные клонические судороги. Гемиконвульсивные припадки идентифицировали лишь у детей раннего возраста, согласно критериям ВОЗ, содержащимся в терминологическом словаре по эпилепсии. Клинической особенностью атонических генерализованных пароксизмов являлась неполная утрата сознания, а в целом, по клинической картине, они походили на обмороки.
Самыми частыми причинами гипертермии, провоцировавшей фебрильные припадки, являлись острые респираторно-вирусные инфекции, в том числе грипп, а также ангина и пневмония. В основе этиологии фебрильных припадков находилось органическое повреждение мозга, полученное в период беременности и родов. Наследственный анамнез по церебральным пароксизмам оказался осложненным у 36% больных, из них у 16% по фебрильным припадкам, у 12% по эпилепсии и у 8% по другим ЦП.
Все больные являлись носителями опасных сочетаний факторов риска по эпилепсии в количестве не менее двух. К этиологическим факторам риска отнесли осложнение наследственного анамнеза по эпилепсии, очаговые неврологические симптомы, клинический вариант перинатальной энцефалопатии, по поводу которого ребенок наблюдался до первых фебрильных припадков, либо анамнестические указания на возможность органического повреждения мозга в период беременности и родов, например:
угроза прерывания беременности, асфиксия в родах, наложение акушерских щипцов, вакуум-экстрактора, оказание ручных акушерских пособий, позднее хирургическое родоразрешение, недоношенность и др. Патогенетическими факторами риска считали пароксизмальную активность на ЭЭГ и возраст развертывания припадков старше 5 лет. К клиническим факторам риска отнесли рецидивы пароксизмов, прогрессирующее снижение температуры тела, провоцировавшей повторные приступы, продолжительность судорог более 5 мин., серийное течение пароксизмов.
Формирование манифестных проявлений эпилепсии посредством повторно развертывающихся фебрильных припадков иллюстрирует наблюдение 1.
Наблюдение1, Больной Л.. 4года. история болезни N 650, поступил в клинику 10.07.94 г.
Жалобы. У ребенка на протяжении последнего года развертываются 2 разновидности ЦП. Первая разновидность - генерализованные судорожные приступы продолжительностью около 2 минут с утратой сознания и послеприступным сном. Вторая разновидность - слюнотечение, миоклонии нижнемимических мышц, клонические судороги в мышцах правой руки и ноги без марша, продолжительностью до 1-2 минут, с утратой сознания в конце приступа и замедленным выходом с последующей слабостью в мышцах правой руки.
Анамнез заболевания. Первый приступ развернулся в возрасте 2 г 4 мес. во время ОРВИ на температуру 38,5 и носил характер эпилептического генерализованного судорожного припадка grand mal. В последующем было еще два подобных приступа с интервалом в 1 - 1,5 месяца. Через 5 месяцев после первого приступа, такой же пароксизм развернулся на фоне ОРВИ и субфебрильной температуры. В последующем фебрильные приступы на температуру 39 - 39,5 чередовались с афебрильными с частотой 1 раз в 1 - 2 мес. до возраста 3,5 лет. Затем характер приступов изменился, появилась вторая их разновидность, описанная в разделе жалоб, они развертывались с частотой 1 - 2 раза в месяц и все носили спонтанный неспровоцированный характер.
Анамнез жизни. Мальчик рожден 34 - летней матерью от 5-й беременности, 3-х родов. Беременность протекала в условиях токсикоза и угрозы не вынашивания. Роды запоздалые, затрудненные, с застреванием плечика и последующим выведением его из-под лонного сочленения посредством ручной тракции за головку. Состояние ребенка при рождении тяжелое, оценено 1-2 баллами по шкале Ангар. Первые 12 часов жизни находился в реанимационном отделении. Дыхание осуществлялось посредством искусственной вентиляции легких. На первом году жизни наблюдался и лечился по поводу перинатальной гипоксически-травматической энцефаломиелопатии, задержки психомоторного развития и акушерского паралича Дюшенна-Эрба. Часто болеет респираторными инфекциями. Наследственный анамнез по церебральным пароксизмам не отягощен.
Данные объективного исследования. В соматическом статусе: малые аномалии развития в количестве более 6.
В неврологическом статусе: сходящееся косоглазие слева, установочный мелко размашистый нистагм вправо и влево, легко опущен правый угол рта, кончик языка отклоняется вправо. Сухожильные и периостальные рефлексы справа выше, чем слева.
Ребенок отстает в психомоторном развитии от сверстников. Говорит отдельные слова и фразы из 2-х слов.
Обзорная краниография. Кости свода черепа обычной толщины, черепные швы не изменены. Умеренно выражен рисунок пальцевых вдавлений. Область турецкого седла без особенностей. Основная пазуха слабо развита. В связи с появившимся парциальным характером припадков и наличием правостороннего пирамидного синдрома произведена компьютерная томография головного мозга.
Компьютерная томография. На серии КТ очагов патологической плотности в веществе головного мозга не определяется. Срединные структуры не смещены. Желудочки обычной формы, незначительно и равномерно увеличены в размерах; ликворные пространства не расширены. Умеренно уплотнен мозговой серп. Заключение: данных за объемный процесс в веществе мозга не выявлено.
Эхоэнцефалоскопия. Смещения срединных структур мозга нет. Пульсация ЭХО - сигналов не увеличена. Признаки незначительного равномерного увеличения объема боковых желудочков мозга.
Электроэнцефалография - (рисунок 5) ЗЭГ носит полиморфный характер, доминирует высоко амплитудная активность. На этом фоне регистрируется очаг эпилептической активности в левой гемисфере, преимущественно в лобно - теменных отведениях, с признаками вторичной генерализации.
Клинический диагноз. Эпилепсия. Полиморфные припадки.
Рекомендовано плановое противоэпилептическое лечение по курсовой методике с постоянным приемом финлепсина 20 мг/кг массы в сутки с распределением суточной дозы на 3 приема, ЭЭГ контроль дважды в год, активное диспансерное наблюдение.
Резюме. У ребенка, перенесшего гипоксически-травматическую перинатальную энцефалопатию тяжелой степени, с хорошим восстановлением большой моторики, в возрасте 2.5 лет начались фебрильные припадки, первый из которых развернулся лишь на фебрильную температуру, но не на
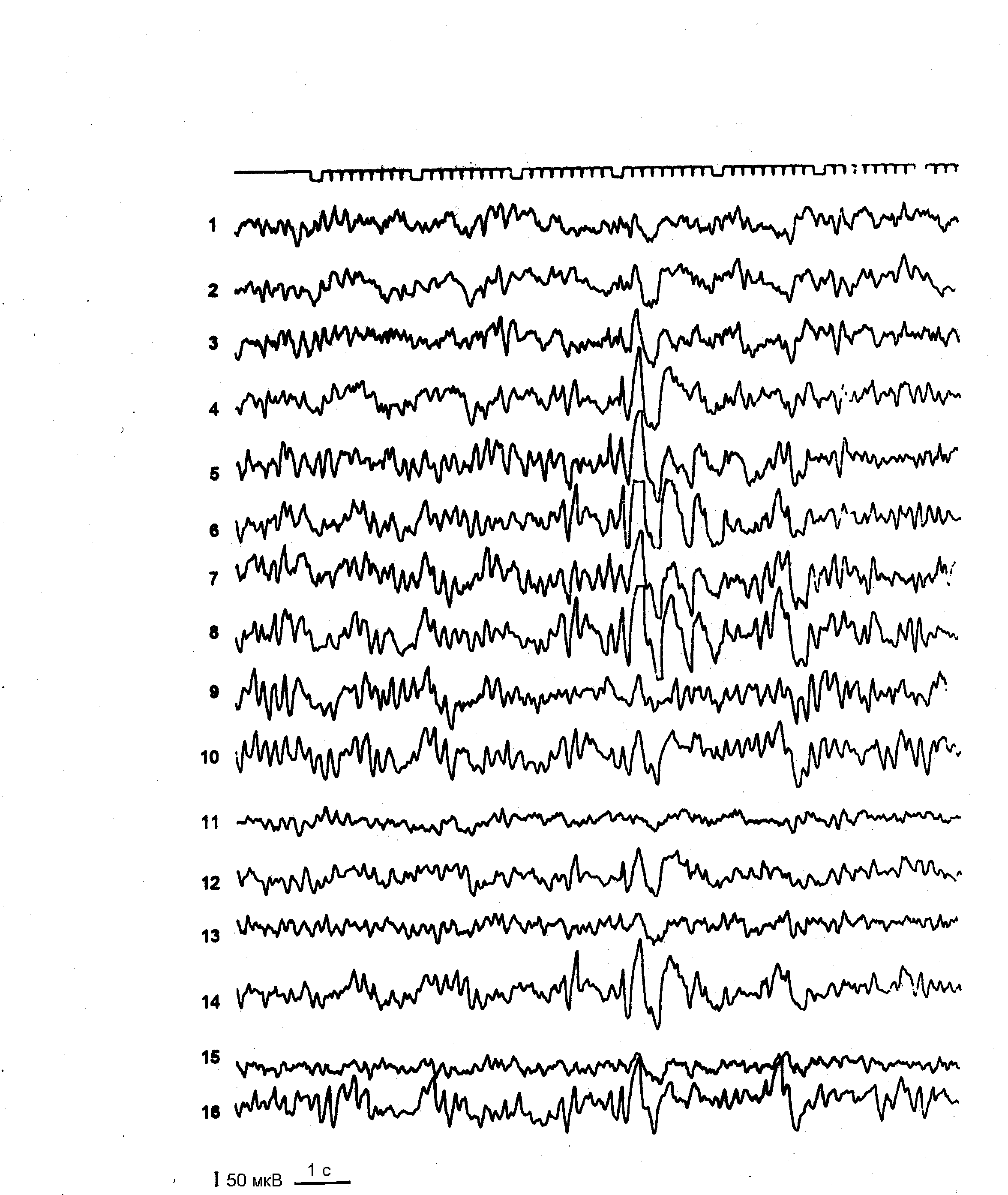
![]()
![]()
1-16 – отведения: 1 – правое лобное; 2 – левое лобное; 3 – правое лобно-центральное; 4 – левое лобно-центральное; 5 правое центрально-теменное; 6 – левое центрально-теменное; 7 – правое теменно-затылочное; 8 – левое теменно-затылочное; 9 – правое лобно-височное; 10 – левое лобно-височное; 11 – правое центрально-височное; 12 – левое центрально-височное; 13 – правое теменно-височное; 14 – левое теменно-височное; 15 – правое височно-затылочное; 16 – левое височно-затылочное.
гипертермию. Донозологический период эпилепсии продолжался около 11 месяцев и закончился после второго неспровоцированного парциального судорожного припадка с вторичной генерализацией. Обращает на себя внимание период параллельного развертывания фебрильных и афебрильных припадков, а также появление фебрильных припадков на субфебрильные значения температуры тела в конце донозологического периода эпилепсии.
Эпилептический синдром в донозологическом периоде эпилепсии выявлен у 69 (15%) больных. Основным критерием эпилептического синдрома считали текущее органическое заболевание мозга в остром или восстановительном периоде, в клинической картине которого имели место единичные (55%) или повторные (45%) эпилептические припадки. У 87% больных припадки были генерализованными судорожными и у 13% парциальными. У всех больных припадки являлись мономорфными. Основное количество наблюдений (54) составили дети, которые на первом году жизни находились в раннем или позднем восстановительном периоде перинатальной энцефалопатии, и имели эпилептические припадки. Далее следовали заболевания энцефалитами (8) и дети с черепно-мозговой травмой (7). Данная группа наблюдений не содержит больных с рецидивами или первичным проявлением эпилептических припадков в периоде остаточных явлений или последствий выше названных заболеваний. Так, например, поздний восстановительный период перинатальной энцефалопатии, еще дававший основания диагностировать эпилептические припадки в качестве эпилептического синдрома, считали законченным у доношенных детей в возрасте 12 мес. и при недоношенности различной степени - в возрасте 18-24 мес. Продолжительность восстановительного периода у больных энцефалитами и черепно-мозговой травмой исчисляли в 2 года.
Клинические варианты перинатальной энцефалопатии с эпилептическим синдромом и конечным исходом в олигофрению, гидроцефалию и детский церебральный паралич, были так же исключены из данной группы наблюдений, несмотря на персистирование у этих больных эпилептических припадков в силу того, что в итоге, диагноз эпилепсии в этих наблюдениях не был поставлен. В данную группу наблюдений вошли 9 больных с исходом синдрома Веста. По последней международной классификации эпилепсии 1989г. синдром Веста рубрифицируется в качестве клинического варианта эпилепсии у детей грудного возраста. Однако в связи с выявлением у этих больных прямой связи заболевания с воздействием тяжелых факторов риска по перинатальной патологии мозга (асфиксия, позднее оперативное родоразрешение и др.) и диагностированием энцефалопатии в периоде новорожденности, в настоящем исследовании синдром Веста рубрифицирован в качестве эпилептического синдрома перинатальной энцефалопатии согласно приведенным выше критериям.
Кроме эпилептических припадков, в анамнезе больных этой группы обнаруживались и другие синдромы: задержка большой моторики, речевого развития, центральные парезы конечностей различной степени выраженности и с общей тенденцией к регрессированию, задержка общего психомоторного развития и даже его регресс у больных синдромом Веста. Кроме того, у всех больных с черепно-мозговой травмой эпилептические припадки развертывались на фоне постоянной головной боли, и у двух больных энцефалитами в остром периоде заболевания отмечены нарушения высших корковых функций - речи, гнозиса, праксиса. Наследственный анамнез по эпилепсии оказался осложненным у 8 больных, и по другим ЦП – у 13.
Формирование эпилепсии у детей посредством эпилептического синдрома с последующим его выходом в эпилепсию иллюстрирует наблюдение 2.
Наблюдение 2. Больной Ш., 11 лет, история болезни N 1041, поступил в клинику 22.11.94 г.
Жалобы. В течение последнего года у больного развертываются две разновидности приступов с утратой сознания. Одни из них повторяются с частотой 2-3 в 1 месяц и имеют следующее клиническое содержание: в любое время суток и чаше во второй половине дня больной внезапно вскрикивает, теряет сознание, падает, нередко при этом ушибаясь; наступает тоническое напряжение мышц всего тела, остановка дыхания, цианоз лица. Через 20-30 сек, судороги принимают клонический генерализованный характер и продолжаются еще около минуты. Затем судороги прекращаются, и больной засыпает, иногда теряя перед этим мочу. Вторая разновидность приступов состоит в кратковременной утрате сознания с застыванием на несколько секунд в любой позе, и последующим мгновенным возвращением к действительности и возобновлением прерванной приступом деятельности. Эти приступы падением больного не сопровождаются, идут с частотой до нескольких раз в сутки и чаще в средние дневные часы.
Анамнез заболевания. Первый генерализованный судорожный припадок с утратой сознания произошел в возрасте 7 месяцев. Через месяц появились серийные генерализованные вздрагивания нередко с пропульсивным компонентом в виде сгибания головы. Серии развертывались 2-3 раза в неделю по несколько раз в день и по 3-10 приступов в серии. Лечился по поводу перинатальной энцефалопатии с эпилептическим синдромом, остановился в психомоторном развитии. Принимал фенобарбитал и радедорм. В возрасте 15 месяцев вновь возобновились генерализованные судорожные припадки, которые носили фебрильный и афебрильный характер и повторялись с частотой до 1-2 раз в месяц. Лечился фенобарбиталом и депакином. Ремиссии по припадкам достигали нескольких месяцев. С 4-х летнего возраста в течение З-х лет доминировали трудно классифицируемые бессудорожные пароксизмы, сопровождавшиеся нарушением сознания, вялостью, общей бледностью, продолжительностью до нескольких десятков секунд и с частотой до 2-3 в месяц. С 7 летнего возраста до последнего времени - приступы grand mal и простые абсансы, описанные в разделе жалоб.
Анамнез жизни. Рожден 26 летней матерью от 5-й беременности. Первая беременность прервана медицинским абортом и последующие 3 - спонтанными абортами. Настоящая беременность протекала на фоне анемии и угрозы прерывания, по поводу которых мать ребенка дважды была госпитализирована. Роды срочные, стремительные. На протяжении первых месяцев жизни ребенок наблюдался по поводу перинатальной энцефалопатии, протекавшей с синдромом гипервозбудимости и единичных аффективно-респираторных пароксизмов. С 2-х летнего возраста часто болеет. Последние несколько лет переносит ОРВИ до 4 раз в год. Наследственный анамнез по ЦП не отягощен.
Данные объективного исследования. В соматическом статусе клинической патологии не выявлено.
В неврологическом статусе: левая глазная щель уже, чем правая, легкая недостаточность акта конвергенции с 2-х сторон, сглажена левая носогубная складка, легко опущен левый угол рта, кончик языка отклоняется влево. Диффузная, легко выраженная мышечная гипотония. Сухожильные и периостальные рефлексы оживлены, их амплитуда несколько выше слева. Легко пошатывается в простой позе Ромберга. Мальчик расторможен, невнимателен. Говорит мало. Учится на дому.
Заключение окулиста. Непостоянное расходящееся косоглазие левого глаза. Передние отделы глаз без патологии, преломляющие оптические среды прозрачны. Глазное дно: диски зрительных нервов физиологической окраски, с четкими границами, сужены артерии и несколько полнокровны вены сетчатки, патологических очагов нет.
Компьютерная томография. Локальных изменений плотности вещества головного мозга не определяется. Боковые желудочки нормальных размеров, симметричные, без сдвига от средней линии. Конвекситальные щели четко не прослеживаются. Данных за объемный процесс в головном мозге не получено.
Электроэнцефалография. (рисунок 6.) Регистрируются общемозговые изменения органического характера. Периоды медленно волновой ЭЭГ активности высокой амплитуды в отведениях от передних и средних отделов полушарий. Очаг эпилептической активности в глубинных отделах лобно-височной зоны больших полушарий с признаками вторичной генерализации.
Клинический диагноз. Эпилепсия. Полиморфные припадки.
Рекомендовано плановое комплексное антиэпилептическое лечение по курсовой методике. Постоянный прием конвулекса по 30 мг/кг в сутки, ЭЭГ контроль дважды в год, активное диспансерное наблюдение.
Резюме. У ребенка в восстановительном периоде перинатальной
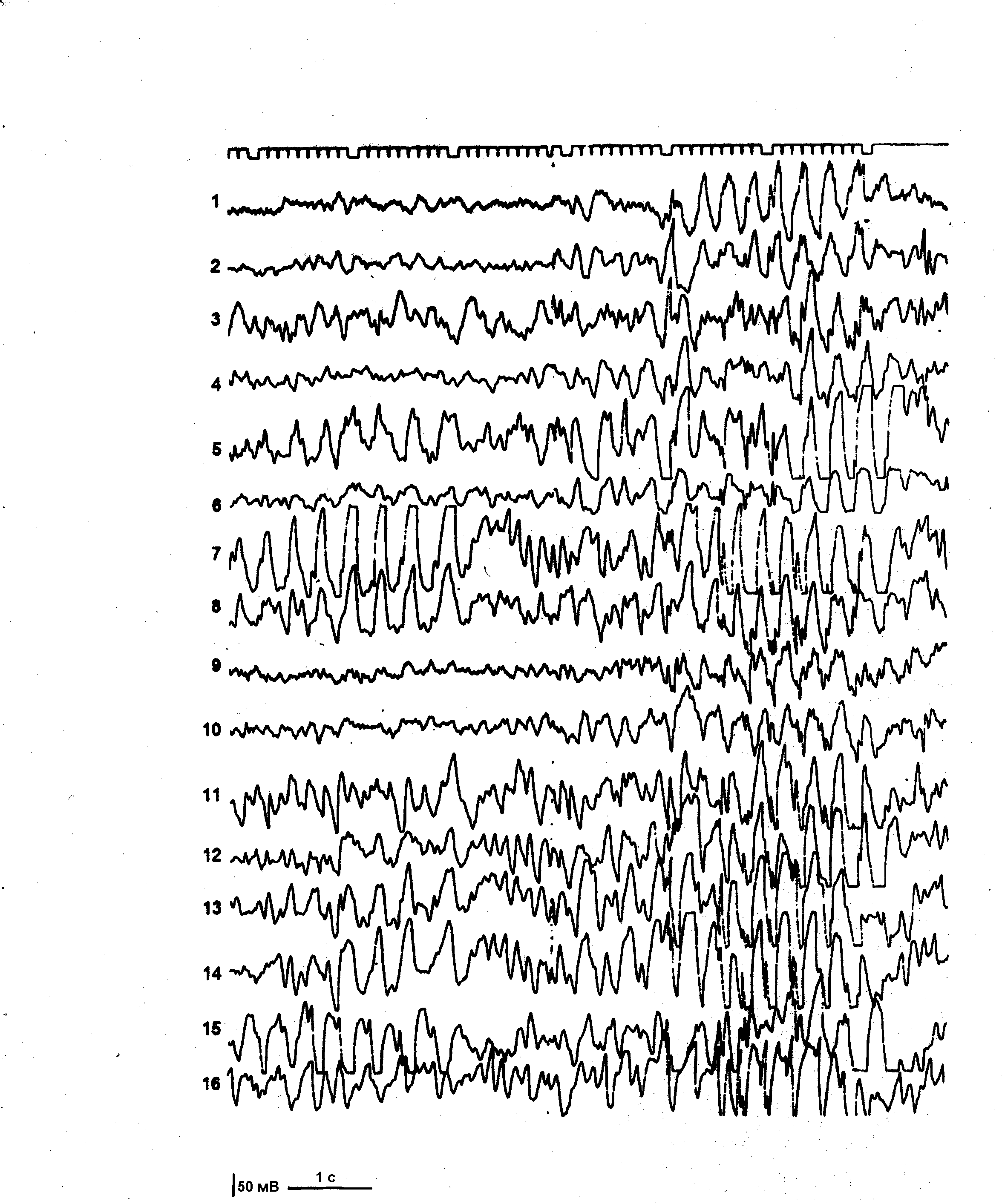
энцефалопатии легкой степени, основным клиническим содержанием которой являлся синдром гипервозбудимости, в 7 месячном возрасте появились эпилептические припадки, диагностированные в качестве эпилептического синдрома, которые после окончания позднего восстановительного периода перинатальной энцефалопатии стали рубрифицироваться в качестве эпилепсии. Однако в клинические проявления донозологического периода эпилепсии в данном наблюдении следует включить не только эпилептические припадки второго полугодия жизни, но и аффективно-респираторные пароксизмы, развертывавшиеся ранее и даже пароксизмальные проявления неонатального периода. Известно, что стандартными клиническими проявлениями синдрома гипервозбудимости новорожденных являются фрагментарные миоклонии и генерализованные вздрагивания, пароксизмы апноэ и «спонтанный» рефлекс Моро, приступы общего двигательного беспокойства, крика, внезапного пробуждения и др. В целом, продолжительность донозологического периода эпилепсии в данном наблюдении составляла около 8 месяцев.
Спонтанные эпилептические припадки в донозологическом периоде эпилепсии выявили у 124 больных, что составило 27% наблюдений. Под спонтанными понимали эпилептические припадки, развертывающиеся в условиях отсутствия очевидных провоцирующих факторов. К очевидным же относили провоцирующие факторы чрезвычайно выраженные по силе, легко выявляемые, действовавшие в непосредственной временной близости в пределах от нескольких часов до суток перед появлением припадка и дававшие основание оценивать первые эпилептические припадки в качестве эпилептической реакции.
Однако мы считали, что любому эпилептическому припадку предшествовали изменения гомеостаза, выходящие за рамки его физиологических колебаний у конкретного больного в условиях определенной поведенческой деятельности. Они провоцировали припадок или активировали его клинически при наличии электроэнцефалографических проявлений припадка, которые не могли быть зарегистрированы. При повышенной пароксизмальной готовности мозга, и особенно в детском возрасте, первые эпилептические припадки могли быть спровоцированы и менее очевидными или незаметными факторами. При этом модальность их могла быть и одинаковой с модальностью факторов, провоцирующих эпилептическую реакцию. Имеются в виду такие факторы, как нарушения клинической и нейрофизиологической структуры сна, незначительная его депривация, феномены гипервентиляции и апноэ во сне, сон в неудобном положении ребенка, например лицом вниз, что может легко вызвать выраженную гипоксию мозга, несколько удлиненный перерыв в приеме пищи (гипогликемия!), пребывание в среде с неизвестными ранее для данного ребенка аллергенами, отставленные от начала припадка на необычно продолжительное время эмоциональный фактор или ушиб головы, период становления или определенная фаза овариально-менструального цикла и др. Поэтому мы должны оговориться, что хотя там, где это было возможно, эти факторы фиксировались в анамнезе заболевания у многих конкретных больных, в настоящем исследовании спонтанные эпилептические припадки выделены дашь в порядке дифференцирования с эпилептическими реакциями, в которых выявлены очевидные, чрезмерно выраженные по силе провоцирующие факторы, и эпилептическим синдромом, в котором основным патологическим процессом являлось так же очевидное, текущее органическое заболевание мозга.
У 115 больных припадки были генерализованными и у 9 парциальными. Среди генерализованных припадков у 17 больных это были абсансы, а у остальных - генерализованные судорожные припадки. Фактическое количество спонтанных припадков предшествовавших постановке диагноза эпилепсии варьировало весьма широко, поскольку многие больные поступали в стационар под наше наблюдение после нескольких или многих спонтанных припадков. Поэтому окончание донозологического периода эпилепсии определялось у них ретроспективно, по данным анамнеза, после развертывания 2-3 спонтанных, судорожных припадков, либо после первой серии абсансов.
94 больных этой группы были рождены в условиях действия различных сочетаний факторов риска по пре- перинатальной патологии мозга. У 15 больных семейный анамнез оказался осложненным по эпилепсии и у 24 - по другим ЦП. При объективном исследовании малые аномалии развития в количестве 5 и более, рассеянные, двухсторонние очаговые неврологические симптомы выявлены у всех больных. Формирование эпилепсии посредством повторно развертывавшихся спонтанных эпилептических припадков иллюстрирует наблюдение 3.
Наблюдение 3. Больной Ч., 4 г., история болезни №904 поступил в клинику 29.09.94г.
Жалобы. Накануне днем у больного развернулся пароксизм следующего характера: внезапно, без каких-либо предшествующих провоцирующих факторов ребенок застыл, утратил сознание, появилось генерализованное тоническое напряжение мышц в течение нескольких секунд. Больной был подхвачен матерью и уложен в постель. Еще через несколько секунд появились клонические судороги головы и мышц лица, быстро распространившиеся преимущественно на верхние конечности и мышцы туловища и продолжавшиеся несколько десятков секунд. Общая продолжительность приступа составила 1-1,5 мин., после чего больной потерял мочу, уснул и в последующем приступ амнезировал.
Анамнез заболевания. Приступ был четвертым жизни больного. Первый развернулся в возрасте 2 г. 1мес., во время ночного сна, через 40 мин после засыпания и проявился парциальными клоническими судорогами правой половины мышц лица и правой руки, продолжительностью несколько десятков секунд. Во время приступа больной проснулся и с ним был возможен контакт. Второй приступ произошел через 9 мес., был также ночным и его клинические проявления были идентичны первому припадку. Третий ночной приступ произошел через 1 мес. после второго, имел парциальное начало, идентичное первым двум приступам, однако сопровождался распространением судорог на мышцы левой половины лица, левой руки и отсутствием контакта с больным. Назначено постоянное лечение радедормом по 2,5 мг. ежедневно за 30 мин, до ночного сна. Ремиссия по припадкам составила 14 мес., однако затем, на фоне погрешностей с приемом радедорма развернулся четвертый припадок, описанный в разделе жалоб.
Анамнез жизни. Ребенок рожден от 29 летней матерью, от вторых преждевременных родов на 35-й неделе беременности, в условиях гемолитического конфликта по АВО факторам. В неонатальном периоде диагностирована перинатальная энцефалопатия смешанного генеза, которая проявилась затем общей задержкой психомоторного развития в течение первых 1,5 лет жизни. Наследственный анамнез по церебральным пароксизмам не отягощен.
Данные объективного исследования. В соматическом статусе патологических изменений не выявлено.
В неврологическом статусе: сходящееся косоглазие с 2-х сторон, больше выраженное слева, симптом Хвостека с 2-х сторон, диффузная мышечная гипотония легкой степени, коленный рефлекс выше справа. Ребенок астеничен, капризен, жалуется на головную боль.
Заключение окулиста. Содружественное, сходящееся альтернирующее косоглазие, рефракционная амблиопия легкой степени.
Эхоэнцефалоскопия. Эхо-пульсации физиологической амплитуды. М-эхо располагается по средней линии и имеет обычную конфигурацию. Дополнительных эхо-сигналов нет.
Электроэнцефалография. (рисунок 7.) Выраженные диффузные изменения биоэлектрических ритмов. В отведениях от передних и средних отделов полушарий появляются периоды высокоамплитудной дельта и тэта активности с двух сторон. На этом фоне в левых височных и теменных отведениях регистрируется очаг эпилептической активности в виде комплексов пик-волна с признаками генерализации.
Компьютерная томография. На серии КТ очагов патологической плотности в веществе головного мозга не определяется. Срединные структуры не смещены. Желудочки мозга обычной формы и размеров. Наружные ликворные пространства не расширены. Заключение: КТ-данных за объемный процесс в головном мозге не выявлено.
Клинический диагноз. Эпилепсия. Парциальные соматомоторные
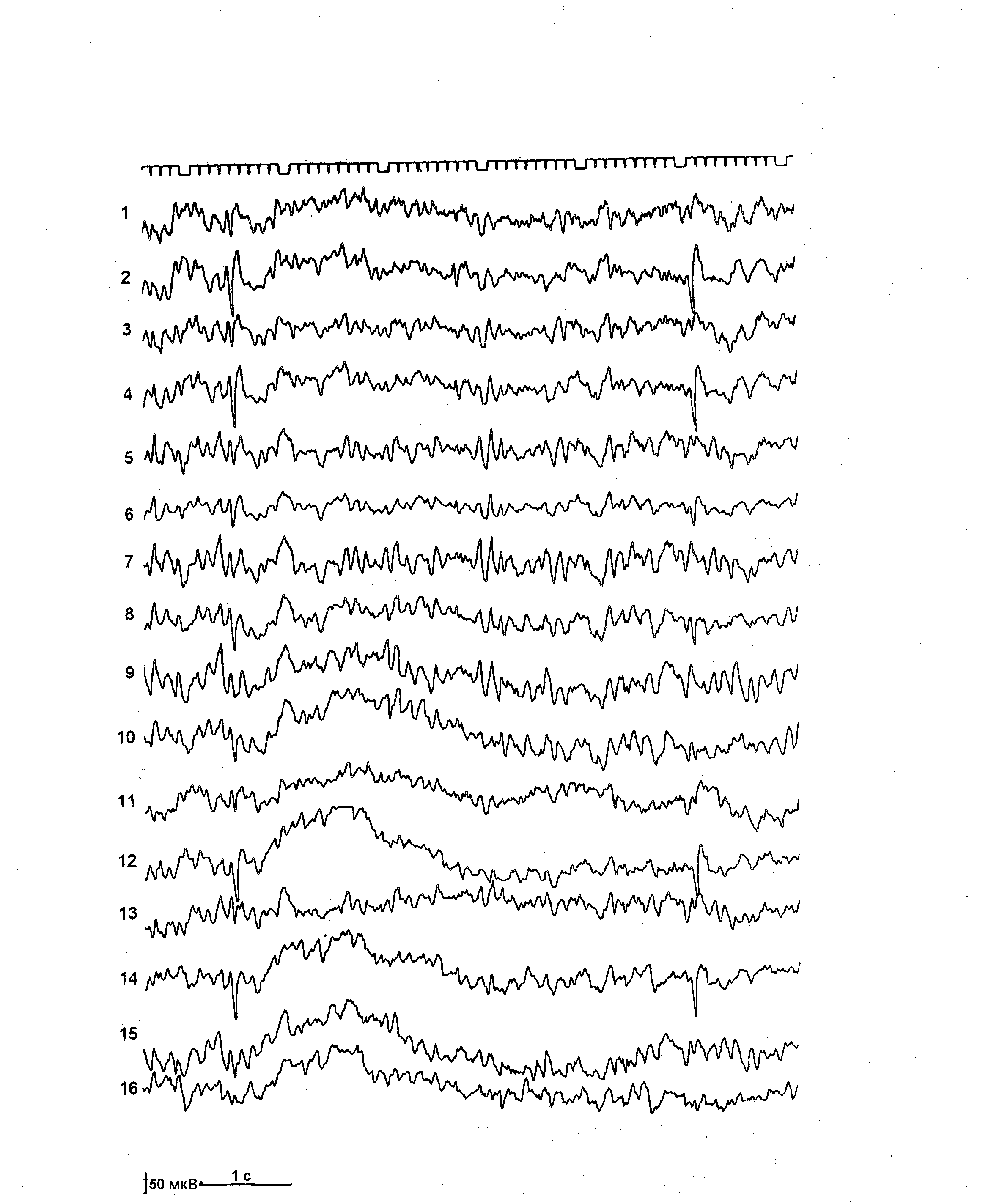
Обозначение те же, что и на рисунке 5.
судорожные клонические припадки с вторичной генерализацией.
Рекомендовано плановое противоэпилептическое лечение по курсовой методике с постоянным приемом фенобарбитала по 4 мг/кг. в сут. в 2 приема, ЭЭГ контроль дважды в год, активное диспансерное наблюдение.
Резюме. У ребенка, родившегося в условиях действия факторов риска по перинатальной патологии мозга, с клиническим вариантом перинатальной энцефалопатии, диагностированным в неонатальном периоде, первый спонтанный парциальный эпилептический припадок развернулся во сне. Донозологический период эпилепсии продолжался 10 мес. и закончился двумя припадками, прошедшими с интервалом в 1 мес., из которых последний имел признаки вторичной генерализации. Однако, диагноз эпилепсии был поставлен лишь после четвертого припадка, имевшего генерализованный и судорожный характер и развернувшегося днем на фоне погрешностей приема АЭП. В связи со сменой характера и расписания припадков, нитразепам был заменен на фенобарбитал.
В заключение данного раздела приводим результаты анализа условий формирования эпилепсии у больных эпилептическим синдромом и единичными спонтанными эпилептическими припадками. Факторами риска по эпилепсии у этих больных являлись следующее: наличие текущего, либо перенесенного органического заболевания мозга, наследственный анамнез, осложненный по эпилепсии, пароксизмальная активность на ЭЭГ и ошибки в медицинской тактике при ведении этих больных и, в первую очередь дефекты в проведении специфической антиэпилептической терапии.
Таким образом, у 66% больных эпилепсией в личном пароксизмальном анамнезе обнаружены единичные эпилептические пароксизмы, которые подразделены на неспровоцированные припадки (124), эпилептическую реакцию (111) и эпилептический синдром (69). С течением времени, единичные эпилептические припадки неоднократно рецидивировали, принимали спонтанный характер у всех больных, и в целом эпилепсия у них формировалась на фоне носительства опасных сочетаний значимых факторов риска по этому заболеванию. Период донозологических проявлений эпилепсии в этих наблюдениях в среднем продолжался около года и не был эффективно использован для проведения превентивной антиэпилептической терапии.
2.2. Неэпилептические пароксизмы в донозологическом периоде эпилепсии у детей
Повторные атипично протекающие неэпилептические пароксизмы обнаружены в личном анамнезе 156 (34%) больных эпилепсией. Клиническая структура, количество и удельный вес различных разновидностей этих пароксизмов ранее представлены в таблице 5. У 14% больных это были парасомнии, у 6% - аффективно-респираторные припадки, у 4% – вегетативные пароксизмы, у 2% - обмороки, у 1,5% - метаболические и у 6,5% - сочетания нескольких разновидностей неэпилептических пароксизмов.
Выделение данного клинического варианта донозологических проявлений эпилепсии накладывало на нас определенную ответственность, ибо противоречит традиционным, а вернее консервативным взглядам на формирование эпилепсии у детей. Консервативность представлений о природе церебральных пароксизмов состоит в постоянном и полном разделении, и даже в противопоставлении эпилептических и неэпилептических пароксизмов у всех больных. Такой подход вызван необходимостью жесткого и бескомпромиссного дифференцирования эпилепсии в связи с социальной тяжестью этого заболевания, необходимостью назначения продолжительного (порой на протяжении всей жизни!) приема АЭП и возможностью тяжелого прогрессирующего течения заболевания с исходом в инвалидизацию больного. А неэпилептические пароксизмы имеют, как правило, доброкачественное течение и благоприятный прогноз.
Разумеется, подобный подход является оправданным в стадии развернутых клинических проявлений эпилепсии, когда действительно, эпилептические припадки у больного эпилепсией и заболевание в целом, имеют коренные отличия от неэпилептических пароксизмов и заболеваний, при которых они наблюдаются. Но даже и в этих случаях, характеризующихся законченными вариантами заболевания, трудности дифференциальной диагностики является объективными. Они связаны с тем, что в природе всех ЦП имеется много общего. Например, клиническая феноменология эпилептических и неэпилептических пароксизмов настолько близка, что вынуждает дифференцировать их буквально в каждом наблюдении. Неэпилептические ЦП не контролируются больным также, как и ЭП. Однако на наш взгляд, не менее важными являются и определенные общности этиологии, патогенеза и топического диагноза, т.е. всего того, что можно назвать неврологией ЦП исследованной автором [Миридонов В.Т., 1995, 1996]. Здесь же приводим собственные данные по клиническому содержанию донозологического периода эпилепсии, проявлявшегося атипично протекающими неэпилептическим пароксизмами.
Парасомнии в донозологическом периоде эпилепсии у детей были представлены ночными страхами у 31 больного эпилепсией, миоклониями во сне - у 21 и снохождениями - у 13. Клиническая картина типичных эпизодов ночных страхов неэпилептического происхождения, со слов родителей расценивалось врачами как проявление невроза. И действительно, после воздействия психотравмы накануне днем или вечером, ребенок как будто пробуждался примерно через один час после засыпания, нередко садился в постели с открытыми глазами. Самым же ярким проявлением эпизода было выражение эмоции страха на лице, слезы. Ребенок звал близких или произносил бессвязные слова. Вегетативный аккомпанемент приступа был также выраженным: гиперемия лица, тахипноэ, ознобоподобное дрожание. Постепенно, в присутствии близких людей ребенок успокаивался, засыпал спокойным сном и наутро нередко ничего не помнил о приступе, продолжительность которого составляла несколько минут.
Подобные ночные страхи наблюдались нами у больных второй группы, и хотя по своим клиническим проявлениям они походили на психомоторные эпилептические припадки, прогноз их был обычно благоприятным и сами они с возрастом прекращались. Однако, у наших больных в донозологическом периоде эпилепсии динамика их была другой. Иногда уже в начале заболевания, но чаще при повторении пароксизмов, они постепенно утрачивали типичную волнообразность течения и связь с психотравмирующей ситуацией, становились более кратковременными, стереотипными и цикличными. Выраженность эмоции страха и вегетативных нарушений уменьшалось. На этом фоне у больных появлялись первые эпилептические припадки.
Ночные миоклонии представляли собой вздрагивания во сне. В начале заболевания они проявлялись только в период засыпания единичными или немногочисленными фрагментарными миоклониями мышц конечностей, туловища, головы, не замечались больными и обращали на себя внимание только родителей. С течением времени, обычно на протяжении нескольких месяцев, вздрагивания становились частыми, нередко генерализованными и появлялись не только в период дремоты или засыпания, но и в течение всей первой половины ночи. Многократные фрагментарные или генерализованные миоклонии приводили к пробуждению ребенка, переживанию неприятных ощущений, не всегда поддающихся описанию. У некоторых больных перед появлением первых эпилептических припадков, вздрагивания появлялись в течении всего периода ночного сна, в дневном сне, в период пробуждения и в бодрствовании.
Типичные неэпилептические снохождения проявлялись следующим образом: обычно в первой половине ночи ребенок вставал с постели, шел, обходя препятствия. Иногда родителям казалось, что ребенок выполняет какую-то деятельность. Выражение лица спокойное, глаза открыты, иногда больной хотя и односложно, но адекватно отвечал на вопросы. Продолжительность пароксизма составляла несколько минут, по истечении которых ребенок самостоятельно, либо с помощью близких возвращался в постель, и легко мог быть разбужен на протяжении всего пароксизма. Полная амнезия ночного приступа не была характерной. У больных старшего детского возраста сохранялось критическое отношение и тягостные переживания, связанные с проявлением заболевания. Клинический атипизм неэпилептических снохождений проявлялся сокращением их продолжительности, увеличением частоты, бедностью и автоматизированностью произвольных действий, утратой связи с психотравмирующими факторами, элементами стереотипности и цикличности. Кроме того, больного не всегда удавалось разбудить, и некоторые пароксизмы полностью амнезировались.
В анамнезе у 18 больных эпилепсией описанные пароксизмы сочетались между собой и с другими парасомниями: энурезом, сноговорениями, бруксизмом и двигательными стереотипиями. У детей младшего возраста ночные страхи чаще всего сочетались с энурезом и двигательными стереотипиями, а у более старших детей - снохождения сочетались со сноговорениями и реже с энурезом и бруксизмом. В связи с этим, с течением времени, общая частота парасомниями существенно увеличивалась.
Таким образом, атипизм клинических проявлений парасомний в донозологическом периоде эпилепсии состоял в постепенной утрате клинической феноменологии и обстоятельств развертывания, характерных для типичных неэпилептических пароксизмов, и наоборот, в приобретении признаков, свойственных эпилептическим припадкам, а также в появлении полиморфизма парасомний и общем увеличении их частоты.
Следует также отметить и существенные трудности дифференциальной диагностики атипично протекающих парасомний с эпилептическим припадками лимбического происхождения, которые по данным литературы и собственных исследований, в значительной мере связаны с общностью топического диагноза всех или большинства парасомний и ЭП, развертывающихся во сне, а именно с нарушением функции срединных структур мозга. Вот почему представляются важными наши данные, свидетельствующие о возможной преемственной связи детских парасомний с развивающейся в последствии эпилепсией у части из этих больных.
В собственном исследовании [Миридонов В.Т., 1992] изучено 110 больных с ночными пароксизмами в возрасте от нескольких месяцев до 15 лет, обследованных клинически и методом ЭЭГ. Выделено 2 группы наблюдений. Первую составили 50 больных эпилепсией с эпилептическими припадками во сне. Оказалось, что лишь у 15 из них первые пароксизмы были эпилептическими припадками, а у остальных 35 - последние появились на фоне парасомний: у 12 - снохождений и сноговорений; у 12 – ночных страхов; у 11 - вздрагиваний во сне и двигательных стереотипий. Выявлены следующие особенности присоединения эпилептических припадков: у 11 больных они полностью сменили гипнические пароксизмы и не имели с ними клинического сходства; у 10 больных парасомнии продолжали сосуществовать с непохожими на них по клиническим проявлениям эпилептическими припадками; у 6 – снохождения и ночные страхи сменились ночными, а у 2 - и дневными психомоторными эпилептическими припадками, вздрагивания во сне у 2 больных - миоклоническими абсансами при пробуждении и у одного больного - эпилепсией «grand mal». На материале 35 больных эпилепсией с парасомниями в анамнезе выделены факторы риска по эпилепсии высокой значимости в сочетании не менее З-х в каждом наблюдении: повторяемость парасомний, наследственный анамнез, осложненный по эпилепсии, синдром повышенной нейрорефлекторной возбудимости, либо нарушения сна и бодрствования в раннем детском возрасте, пароксизмальная активность на ЭЭГ и клинический атипизм парасомний.
Вторую группу наблюдений составили 60 больных с парасомниями: ночными страхами - 23, снохождениями - 20, вздрагиваниями во сне - 13 и ночными двигательными стереотипиями - у 4 больных. Факторы риска по эпилепсии в сочетании не менее 3 обнаружены у 23 больных: у 9 - со снохождениями, у 8 - с ночными страхами, у 6 - со вздрагиваниями во сне и у 2 - с двигательными стереотипиями. В 8 наблюдениях обнаружен атипизм клинической семиологии и обстоятельств развертывания парасомний в сторону приобретения последними клинических черт эпилептических припадков.
Основу этиологии пароксизмальных нарушений сна в наших наблюдениях составили органические повреждения мозга, полученные в пре- перинатальном периоде - 88% больных были рождены в условиях воздействия факторов риска по пре- и перинатальной органической патологии мозга. В раннем детстве эти повреждения коррелировали с высокой частотой синдрома гипервозбудимости и нарушении сна и бодрствования. На этом клиническом фоне проявлялись парасомнии и реже – эпилептические припадки во сне. При отсутствии факторов риска по эпилепсии гипнические пароксизмы прекращались, либо продолжались в неизменном виде. У части больных. имевших значимые факторы риска в опасных сочетаниях появлялись эпилептические припадки, сменяющие парасомнии, либо сосуществующие вместе с ними. Клинические особенности парасомний в донозологическом периоде эпилепсии иллюстрирует наблюдение 4.
Наблюдение 4. Больной О., 6,5 лет, история болезни N 878, поступил в клинику 19.09.94 г.
Жалобы. Утренние приступы генерализованных тонико-клонических судорог с утратой сознания, продолжительностью около 2 минут, с послеприступным сном.
Анамнез заболевания. С возраста 3,5 лет у мальчика появились пароксизмальные нарушения сна: ночной энурез, устрашающие сновидения, ночные страхи, сноговорения, бруксизм, снохождения. Количество этих эпизодов не поддается подсчету. Они протекали волнообразно, периоды обострений были связаны преимущественно с общими инфекционными заболеваниями и иногда с психотравмой. С возраста 4,5 до 5,5 лет эпизоды снохождений обнаружили определенную динамику: в начале они были редкими и рудиментарными - больной садился в постели, произносил слова, обрывки фраз, соответствующие событиям прошедшего дня, а к концу периода становились более сложными - больной вставал с постели, передвигался по комнате, ощупывал предметы и как правило, бывал разбужен родителями и укладывался ими в постель. Общая продолжительность приступа достигала нескольких минут. Последние 3 эпизода снохождений были спонтанными, вне связи с какими - либо провоцирующими факторами. Перечисленные ночные пароксизмы продолжаются у ребенка до настоящего времени, однако общая частота их начала снижаться. В возрасте 5,5 лет, на фоне З-х дневной вынужденной частичной депривации ночного сна, утром перед пробуждением развернулся большой судорожный генерализованный тонико-клонический припадок, продолжительностью около 2 минут, с последующим сном, с астенией и головной болью после пробуждения. Больному был назначен постоянный прием фенобарбитала на ночь. Судорожные приступы не повторялись и пароксизмальные нарушения сна становились реже. Через 7 месяцев прием фенобарбитала был прекращен без ведома врача, и еще через 3 месяца в 9 утра развернулся второй генерализованный эпилептический припадок типа grand mal.
Анамнез жизни. Ребенок рожден 20 - летней матерью, страдающей врожденным пороком сердца. Беременность протекала с анемией и на фоне инфекции моче - половой системы, по поводу которой мать ребенка принимала лечение антибиотиками. Беременность переношенная. Роды в 42 недели со стимуляцией. Ребенок родился в асфиксии легкой степени с зелеными околоплодными водами, ослабленным, и к груди был приложен лишь на 3 - и сутки. Общее состояние по шкале Ангар оценено в 7 - 8 баллов. В неонатальном периоде диагностирована гемолитическая болезнь новорожденных, обусловленная гемолитическим конфликтом по АВО факторам. Большая моторика ребенка формировалась по возрасту, однако отмечалась задержка речевого развития - простые фразы из 2-х слов начал произносить в возрасте 2,5 лет. Ребенок рос гипервозбудимым, расторможенным, рано стал отказываться от дневного засыпания, и в то же время быстро уставал от обычных нагрузок, с 6-х лет начал жаловаться на головные боли. Часто болел простудными и кишечными заболеваниями, страдал аллергией. Наследственный анамнез по церебральным пароксизмам не отягощен.
Данные объективного исследования. В соматическом статусе патологических изменений не выявлено.
Неврологический статус. Сходящееся косоглазие легкой степени слева, сглаженность левой носогубной складки и девиация кончика языка влево. Диффузная, легко выраженная мышечная гипотония. Легкая гипотрофия мышц плечевого пояса. Подошвенный рефлекс слева атипичен. Интенционное дрожание при выполнении пальце - носовой пробы справа. Поведение гиперактивное. Жалуется на головные боли, устрашающие сновидения.
Заключение окулиста. VOD = 1,0; VOS = 1,0. Передний отдел глаз без патологии. Оптические среды прозрачны. Глазное дно: диски зрительных нервов физиологической окраски, с четкими границами, сужены артерии и несколько полнокровны вены сетчатки. Патологических очагов не обнаружено.
Обзорная краниография и рентгенография области краниовертебрального перехода в боковых проекциях с 2-х сторон. Размеры мозгового черепа возрастные. Просветы швов допустимые. Усилен диплоический венозный рисунок. Пальцевые вдавления средней глубины, с легким акцентом в затылочной области. Турецкое седло достаточно структурировано. Черепные ямы каскадны. В области краниовертебрального перехода - аномалия Кимерле.
Эхоэнцефалоскопия. Смещения срединных структур мозга нет. Число Эхо - пульсаций не увеличено.
Электроэнцефалография (рисунок 8.) Легко выраженные признаки диффузных изменений и запаздывания церебрального электрогенеза. Реактивность на функциональные нагрузки удовлетворительная. На этом фоне регистрируется очаг эпилептической активности в отведениях от правой теменной зоны мозга - пароксизмальные комплексы пик - волна.
Клинический диагноз. Эпилепсия. Эпилептические припадки grand mal.
Рекомендовано плановое противоэпилептическое лечение по курсовой методике с постоянным приемом фенобарбитала по 4,0 мг/кг в сутки в два приема. ЭЭГ контроль дважды в год, активное диспансерное наблюдение.
Резюме. Ребенок рожден в условиях действия сочетанных факторов риска периода беременности и родов, с клиническим вариантом перинатальной
энцефалопатии, с синдромом гипервозбудимости. Донозологический период эпилепсии протекал около 2-х лет и был представлен полиморфными гипническими пароксизмами, протекавшими с высокой частотой и признаками клинической атипичности. Диагноз эпилепсии поставлен после второго неспровоцированного эпилептического припадка. Пароксизмальные нарушения сна неэпилептического характера продолжались после первого и второго эпилептических припадков.
Аффективно-респираторные припадки (АРП) в донозологическом периоде эпилепсии встретились у 28 больных (6%), из которых у 12 они сочетались с повторными парасомниями (8) и единичными фебрильными припадками (4). В типичных случаях клинические проявления припадка развивались быстро, в течение нескольких секунд: под воздействием эмоционального провоцирующего фактора (боль, страх, обида, гнев

Обозначение те же, что и на рис. 5.
неудовлетворенное желание и др.) ребенок начинал рыдать, производил при этом несколько всхлипываний синхронных со ступенчатым, саккадированным выдохом, и на высоте выдоха развивалось апноэ; при этом нередко рот ребенка оставался открытым в крике. Одновременно с апноэ наступала утрата сознания, появлялся цианоз носогубного треугольника, лица и реже кожных покровов всего тела, ребенок обмякал и мог упасть. Во время приступа сознание отсутствовало, зрачки были умерено расширены, выявлялась диффузная мышечная гипотония и гипорефлексия сухожильных, периостальных рефлексов и рефлексов со слизистых. Приступ продолжался до нескольких десятков секунд. Признаком окончания пароксизма являлся глубокий вдох, вслед за которым наступало немедленное восстановление сознания, исходного мышечного тонуса, а затем и редукция цианоза. Обычно ребенок продолжал плакать еще некоторое время и затем постепенно успокаивался. Таким образом, типичные АРП в наших наблюдениях были бессудорожными, редкими и как правило прекращались в возрасте старше 3 лет.
В донозологическом периоде эпилепсии у всех больных АРП отмечались своей большой продолжительностью и клинической тяжестью. Так у 19 больных они были судорожными, причем судороги носили генерализованный тонический характер по типу опистотонуса, развивались вслед за появлением цианоза и продолжались до конца приступа. У 5 больных после тонического компонента судорог развивались кратковременные клонии мышц конечностей, головы. У 6 больных наступал послеприступный сон и у 3 - потеря мочи в конце приступа. Кроме того, у 10 детей по мере приближения первых эпилептических припадков частота АРП увеличивалась до ежедневной и у 14 – до 2-3 приступов в день. При этом интенсивность провоцирующих факторов снижалась настолько, что по мнению родителей, АРП у этих детей развивались спонтанно.
Нами выявлены два основных варианта «вхождения» больных АРП в эпилепсию. У 74% с приступами средней частоты и клинической тяжести первые эпилептические припадки развивались после ремиссии по АРП, продолжительностью от нескольких недель до нескольких месяцев. У остальных 26% больных с частыми и тяжелыми АРП первые эпилептические припадки появлялись в промежутке между очередными АРП, которые продолжали повторяться и после следующего эпилептического припадка. Этот период параллельного развертывания АРП и эпилептических припадков также продолжался от нескольких месяцев до 1-1,5 лет, после чего эпилептические припадки полностью сменяли АРП.
Факторами риска по формированию эпилепсии являлись следующие: повторность АРП, наследственность, осложненная по эпилепсии (6) или другим ЦП (12), пароксизмальная активность на ЭЭГ, и атипизм клинических проявлений и обстоятельств развертывания АРП. Последний фактор имел следующее содержание: высокую частоту, включительно до ежедневных или до нескольких приступов в день, низкий порог интенсивности провоцирующих факторов, т.е. кажущаяся спонтанность припадков, судорожный характер и большая продолжительность приступов, потеря мочи и послеприступный сон. Клиническую динамику АРП в анамнезе больных эпилепсией иллюстрирует наблюдение 5.
Наблюдение 5. Больная В., 5 лет, история болезни N 932 поступила в клинику 7.10.94г.
Жалобы. Приступы генерализованных тонико-клонических судорог с утратой сознания и падением, следующих с частотой 5-6 приступов в год и последний из которых имел место 7 мес. назад.
Анамнез заболевания. С 8 месячного возраста появились пароксизмы следующего характера: немедленно после воздействия провоцирующего фактора - отрицательной эмоции, боли, испуга, падения - ребенок начинал плакать и через несколько секунд «закатывался» - наступали апноэ и последующий цианоз, вслед за которыми терялось сознание и появлялись генерализованные тонические судороги продолжительностью до нескольких секунд. В течение последующих 2-х мес. приступы повторялись от случая к случаю с общей частотой раз в неделю. На втором году жизни приступы стали развертываться чаще и протекали тяжелее: продолжительность судорожного компонента увеличивалась и к концу периода достигала 15-20 сек., а общая продолжительность приступа достигала до нескольких десятков секунд. В 1,5 летнем возрасте приступы стали появляться ежедневно, а иногда и по несколько раз в день, причем часть из них утратила связь с провоцирующими факторами. На фоне лечения фенобарбиталом и радедормом, которые больная принимала нерегулярно, приступы повторялись реже, к возрасту 2-х лет приобрели цикличность, спонтанный характер и развертывались с частотой 1 раз в 1,5-2 мес. Эпилепсия диагностирована в 2 г. 7 мес., после нескольких спонтанных генерализованных судорожных пароксизмов. Регулярно принимала фенобарбитал, который через 6 мес. в связи с его непереносимостью заменен радедормом. В возрасте 4 г. 5 мес. развернулся последний эпилептический припадок типа grand mal.
Анамнез жизни. Девочка рождена 19 летней матерью. Беременность первая, протекала с токсикозом первой половины, в первом триместре - ОРВИ, в среднем - анемия беременных. Роды срочные, ускоренные, в условиях узкого таза. Родилась в асфиксии. Оценка общего состояния - 7 баллов по шкале Апгар. Большая моторика, общее психомоторное развитие и становление речи осуществлялись по возрасту. В постнатальной жизни девочка часто переносила ОРВИ. В связи с болезнью отца в семье наблюдалась постоянная психотравмирующая обстановка.
Наследственный анамнез. Отец ребенка с 10 летнего возраста болен эпилепсией.
Данные объективного исследования. В соматическом статусе: 7 малых аномалий развития, гипертрофированные миндалины, подчелюстные лимфатические узлы увеличены в размерах.
В неврологическом статусе: коленный и ахиллов рефлексы справа выше чем слева, непостоянный симптом Бабинского слева. Поведение девочки управляется с трудом. Расторможена, непослушна, гиперактивна, упряма и негативна, проявляет элементы агрессивности.
Заключение окулиста. Передний отдел глаз без патологии, оптические среды прозрачны, глазное дно: диски зрительных нервов розовые, с четкими контурами, артерии сетчатки слегка сужены, вены обычного калибра, патологических очагов не обнаружено.
Обзорная краниография в двух стандартных проекциях. Размеры мозгового черепа в пределах нижней границы возрастной нормы. Швы прослеживаются. В области брегмы просвет до 1,5 мм. края венечного шва несколько уплотнены, по ходу лямбдовидного шва - вставочные косточки. Ямки пахионовых грануляций сконцентрированы вблизи сагиттального шва. Пальцевые вдавления акцентированы в лобной, затылочной и височной зонах. Турецкое седло структурно. Лимб чуть приподнят. Центральная часть передней черепной ямы углублена. Основные пазухи в зачаточном состоянии (норма). В носоглотке - аденоидные вегетации 11 степени. Патологических обызвествлений не выявлено.
Эхоэнцефалоскопия. Смещения срединных структур мозга нет. Число дополнительных эхосигналов не увеличено.
Электроэнцефалография. (рисунок. 9.) Биоэлектрические ритмы диффузно изменены. В отведениях от задних отделов полушарий отмечается тенденция к синхронизации альфа - ритма, в отведениях от средних отделов полушарий - большое количество тета - волн с синхронизацией тета - ритма. В тех же отведениях регистрируются ЭЭГ феномены в виде комплексов острая волна - медленная волна. Регистрируются ЭЭГ признаки повышенной пароксизмальной готовности мозга.
Клинический диагноз. Эпилепсия. Генерализованные большие эпилептические судорожные припадки типа grand mal. Ремиссия по припадкам 7 месяцев.
Рекомендовано плановое противоэпилептическое лечение по курсовой методике с постоянным приемом препаратов нитразепама по 0,3 - 0,4 мг/кг в сутки в 2 приема, ЭЭГ контроль дважды в год, активное диспансерное наблюдение.
Резюме. Ребенок, с наследственностью осложненной по эпилепсии со стороны отца, вынашивался во время беременности и был рожден в условиях действия сочетаний факторов риска по органическому повреждению мозга, хотя клинический вариант энцефалопатии в неонатальном периоде не был
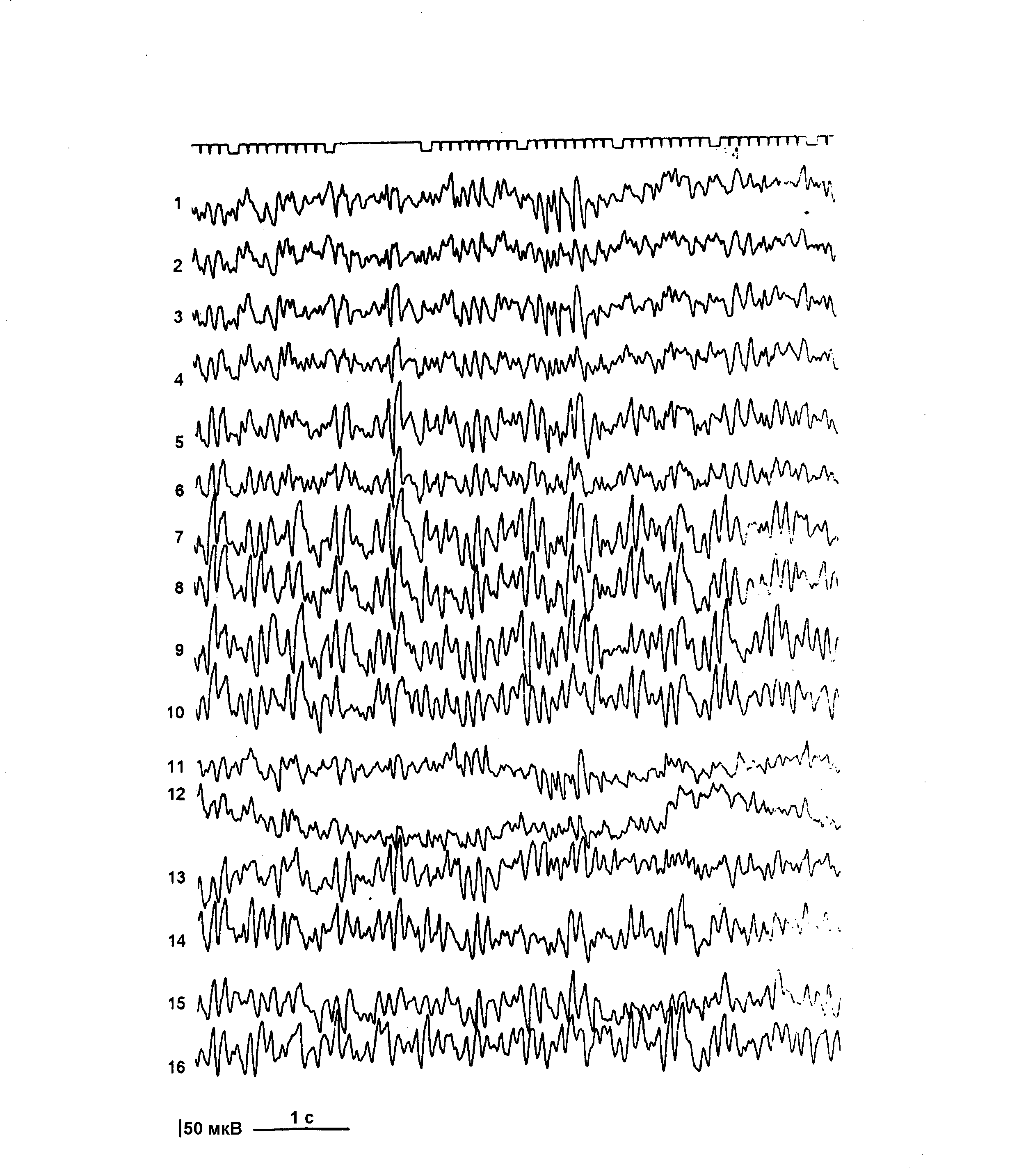
Обозначения те же, что и на рисунке 5.
идентифицирован. В условиях воздействия хронической психотравмирующей ситуации в 8-ми месячном возрасте появились первые тяжелые но типичные аффективно - респираторные припадки, которые на протяжении последующих 1,5 лет приобрели признаки клинической атипичности: высокую частоту, еще большую клиническую тяжесть и стали утрачивать связь с провоцирующими факторами. Продолжительность донозологического периода эпилепсии составила около двух лет. Значимые факторы риска по формированию эпилепсии были налицо уже в начале 2-го года жизни: наследственный анамнез осложненный по эпилепсии, клинический атипизм и тяжесть аффективно - респираторных пароксизмов. Превентивная антиэпилептическая терапия с постоянным приемом АЭП была показана, несмотря на отсутствие соответствующих ЭЭГ данных или невозможность проведения ЭЭГ исследования. Это и было сделано, однако нерегулярный прием АЭП и плохая переносимость фенобарбитала, при недостаточной лечебной активности родителей не позволили остановить эпилепсию в ее донозологическом периоде и заболевание было диагностировано в возрасте 2 года 7 мес. Результаты ЭЭГ исследования оказались примечательны не столько типичными графоэлементами эпилептической активности, которые всего лишь имели место, а наличием высоко-амплитудных синхронизированных тэта - волн в отведениях от средних отделов полушарий указывающих на органическое повреждение и дисфункцию глубинных структур мозга. В целом, на данном этапе заболевание протекает доброкачественно, поскольку достигнута существенная по продолжительности ремиссия по припадкам, а нарушения психики еще не выходят за пределы ее неспецифических изменений.
Вегетативные пароксизмы обнаружены в анамнезе 18 больных эпилепсией. У 11 из них это были пароксизмальные головные боли, у 5 - вегетативно-висцеральные пароксизмы и у 2 больных - полисистемные вегетативные кризы. У 8 больных вегетативные пароксизмы сочетались с другими церебральными пароксизмами: единичными обмороками, пароксизмальными нарушениями сна. У всех больных пароксизмы были повторными и предшествовали от нескольких месяцев до нескольких лет первым эпилептическим припадком. Наследственный анамнез по мигрени был осложнен у 5 больных, по другим пароксизмальным цефалгиям - у 3, по эпилепсии - у 1 и по другим церебральным пароксизмам - у 2.
В донозологическом периоде эпилепсии пароксизмальные головные боли диагностировали в качестве мигрени у 7 больных и вегетативной дистонии с пароксизмальными цефалгиями - у 4. Во всех наблюдениях перед развертыванием первых эпилептических припадков появлялись признаки клинического атипизма пароксизмальных цефалгий: уменьшение продолжительности приступа до нескольких минут, утрата связи с провоцирующими факторами, пульсирующий характер головной боли, редукция других вегетативных симптомов во время приступа, цикличность цефалгий и сонливость после приступа.
Вегетативно-висцеральные пароксизмы в донозологическом периоде эпилепсии у всех детей были диагностированы в рамках невроза. Основным клиническим проявлением приступов оказались боли в области живота продолжительностью до нескольких десятков минут, которые иногда сопровождались рвотой, вздутием живота, гипергидрозом, гиперемией или побледнением кожных покровов, головной болью. С течением времени пароксизмы учащались, становились короче, их клинические проявления ограничивались ощущениями боли вокруг пупка, наступало изменение сознания по типу легкого оглушения или желание заснуть после приступа.
Полисистемные вегетативные кризы в начале заболевания расценивались в качестве вегетативно-висцерально-сосудистой формы гипоталамического синдрома. Приступы были редкими, продолжались до нескольких десятков минут и носили смешанный, симпатико-адреналовый и ваго-инсулярный характер. Перед появлением первых эпилептических припадков приступы учащались и укорачивались, утрачивали полисистемность, наступало притупление чувства тревоги и страха и изменение сознания по типу оглушения легкой степени. Факторами риска у больных вегетативными пароксизмами, создающими угрозу по развертыванию первого эпилептического явились следующее: повторность пароксизмов, наследственность, осложненная по эпилепсии, пароксизмальная активность на ЭЭГ и атипизм клинических проявлений и обстоятельств развертывания вегетативных пароксизмов.
В анамнезе 9 больных эпилепсией обнаружены повторные обморочные пароксизмы, предшествующие первым идентифицированным эпилептическим припадкам на период времени от нескольких месяцев до нескольких лет. По данным анамнеза и медицинских документов у 4 больных первые пароксизмы расценены в качестве типичных нейрогенных обмороков и у 5 - в качестве атипичных, которые отнесли к обморокоподобным пароксизмам. У 4 больных обморочные пароксизмы сочетались с гипническими церебральными пароксизмами.
В клинической картине первых типичных нейрогенных обмороков традиционно можно было выделить две фазы: липотимию и собственно обморок. Липотимия или предобморочное состояние имела продолжительность до нескольких десятков секунд и в своем развернутом варианте содержала клинические симптомы со стороны сенсорной, двигательной, вегетативной и психической сфер. В сенсорной сфере: больные жаловались на появление «мушек перед глазами», «туман», неясность зрения, шум в ушах, головокружение, онемение языка и губ; пальцев рук. В двигательной сфере: нарушение равновесия, походки, падение головы на грудь, тремор конечностей. В вегетативной сфере: ощущение дурноты, тошнота, сердцебиение, бледность кожи, нехватка воздуха, гипергидроз и др. В психической сфере: тревога и страх, боязнь падения, потери сознания и др. У всех больных в анамнезе отмечались и изолированные липотимии, не завершавшиеся развернутым обмороком.
Вторая фаза типичного обморока характеризовалась утратой сознания и падением больного по типу медленного оседания, но не внезапного падения. Продолжительность бессознательного состояния составляла, в среднем 1-2 минуты.
В послеприступном периоде сознание восстанавливалось в течение нескольких секунд. Еще некоторое время больной оставался встревоженным и несколько напуганным случившимся, бледным. гиподинамичным,
У больных типичными обмороками сравнительно легко выявлялись условия, облегчающие развертывание обморока, либо непосредственные провоцирующие факторы. Обычно это были: вид крови, внезапная боль различного происхождения, продолжительное пребывание в душном помещении, в тесноте, в строю, транспорте, бане и др. Продолжительность воздействия провоцирующих факторов и условий колебалось широко: от нескольких секунд при внезапной боли или виде крови до многих часов при пребывании в душном помещении.
В наших наблюдениях при обморокоподобных пароксизмах уже в дебюте, а при типичных обмороках только при их повторном развертывании обнаруживались признаки клинического атипизма обмороков и обстоятельств их развертывания, которые состояли в постепенной утрате некоторых существенных характеристик, присущих типичным нейрогенным обморокам и в параллельном приобретении клинических признаков, свойственных эпилептическим припадкам. Эти признаки были следующими; бессудорожные обмороки становились конвульсивными, причем продолжительность судорожной фазы превышала обычные несколько секунд и увеличивалась далее; выход из приступа замедлялся и сопровождался у 4 больных послеприступным сном; фаза липотимии редуцировалась до полного ее отсутствия как перед обмороком непосредственно, так и в межприступном периоде; порог чувствительности к факторам, обычно провоцирующим обмороки у данного больного снижался настолько, что создавалось впечатление о спонтанности пароксизмов. Одновременно эти больные являлись носителями и других факторов риска по эпилепсии: пароксизмальной активности на ЭЭГ и наследственного анамнеза, осложненного по эпилепсии.
Таким образом, у 34% больных эпилепсией первому эпилептическому припадку предшествовали разнообразные неэпилептические пароксизмы, среди которых господствовали пароксизмальные нарушения сна, аффективно-респираторные припадки и сочетания нескольких разновидностей пароксизмов. У всех больных они были повторными и являлись атипичными по семиологии, обстоятельствам развертывания и клинической тяжести. Кроме того, эти дети нередко являлись носителями и других факторов риска – пароксизмальной активности на ЭЭГ и наследственного анамнеза, осложненного по эпилепсии. На этом фоне развертывались первые эпилептические припадки, проявлявшие склонность к рецидивированию, и в целом донозологический период эпилепсии у этих больных продолжался около 2-х лет. Превентивное антиэпилептическое лечение с использованием постоянного приема профилактических доз АЭП было показано этим детям еще в период повторных неэпилептических пароксизмов, протекавших на фоне и других факторов риска по эпилепсии. В этих случаях оно было бы направлено на профилактику развертывания первого эпилептического припадка.
2.3. Состояние психики в донозологическом периоде эпилепсии у детей.
В отличие от пароксизмального синдрома, динамика которого от первых церебральных пароксизмов до манифестных проявлений эпилепсии сравнительно легко могла быть установлена по данным анамнеза заболевания, расспроса родственников и анализа истории развития ребенка, для изучения состояния поведения и психики ребенка в донозологическом периоде эпилепсии нужен был иной методический подход. Прежде всего, у детей, больных эпилепсией, донозологический период заболевания был завершен. Во-вторых, сведения, полученные в таких случаях от родственников больного, оказывались чрезвычайно скудными и как правило, касались также последнего периода жизни ребенка, характеризовавшегося повторными эпилептическими припадками. Кроме того, при исследовании больного с типичной эпилепсией, мы были лишены возможности лично наблюдать за его поведением в донозологическом периоде болезни, за исключением тех случаев, когда больной госпитализировался неоднократно, в том числе и в период предшествующий постановке диагноза эпилепсии. Вот почему состояние психики, как и ЭЭГ изменения мы изучали не у больных эпилепсией, а у детей группы риска по этому заболеванию, которая была сформирована из больных второй группы наблюдений. В группу риска по эпилепсии вошли больные с единичными эпилептическими припадками, диагностированными вне рамок эпилепсии и с повторными, атипично протекающими неэпилептическими пароксизмами. Как те, так и другие больные являлись носителями опасных сочетаний значимых факторов риска по эпилепсии. Заболевание на данном этапе совершало существенные элементы эволюции в эпилепсию, и самих больных мы расценивали как находящихся в донозологическом периоде этого заболевания, а изучение состояния психики и ЭЭГ изменений у них считали адекватным решением поставленные задач. Принципы и методика формирования группы риска по эпилепсии будут изложены в последнем разделе настоящей главы, результаты ЭЭГ исследований – следующей главе. Здесь же коротко излагаются результаты собственных наблюдений за состоянием поведения и психики больных группы риска по эпилепсии.
На материале 227 больных группы риска по эпилепсии, синдром психических дисфункций был выявлен в 72% наблюдений. Типичные расстройства психики, которые в литературе также называют специфическими оказались у 12% больных, неспецифического типа у - 60%, а у остальных 28% состояние поведения и психики соответствовало возрасту.
Перманентные специфические нарушения психики в целом соответствовали таковым, описанным в классических руководствах по эпилепсии для взрослых и представали в виде следующих основных синдромов: эмоционально-волевых, интелектуально-мнестических расстройств, и изменения поведения и черт характера.
Эмоционально-волевые изменения характеризовались главным образом полярностью эмоционального поведения у одного больного. С одной стороны имелись налицо признаки эмоциональной вязкости, «застревания» на отдельных, особенно отрицательно окрашенных переживаниях, а с другой - склонность к аффективной взрывчатости, импульсивности поведения в определенных ситуациях или при контактах с конкретными лицами.
Интелектуально-мнестические нарушения состояли в замедленности и тугоподвижности мышления, склонности к детализации переживаний, обстоятельности речи и мышления, а также в снижении кратковременной и оперативной памяти. Это приводило к ухудшению успеваемости в школе, в первую очередь по математике, в связи со снижением способности к накоплению информации и сниженного качества абстрактного мышления.
Специфические особенности характера проявлялись эгоцентризмом, концентрацией всех интересов на своих потребностях и желаниях, чрезмерной аккуратностью и пунктуальностью доходящими до педантизма, гиперболизированным отношением к порядку и справедливости, сочетанием грубости и жестокости в отношениях к одним и участливости, слащавости, приторной вежливости и подобострастия - к другим лицам. В качестве существенных особенностей этих основных синдромов специфических нарушений психики можно выделить следующее. Во-первых, они наблюдались не отдельно, а всегда сосуществовали у одного больного, достигая различной степени выраженности. Во вторых, все эти дисфункции были весьма мягкими и ни в одном наблюдении не вызывали выраженной дезадаптации, ограничений посещения школы или изменения ее профиля, пребывания в детских учреждениях и др. Немногочисленные по общему количеству эти наблюдения распределились, тем не менее, равномерно среди всех основных клинических разновидностей группы риска по эпилепсии, в том числе наблюдались у детей с атипично протекающими неэпилептическими пароксизмами. Эти данные подтверждают весьма прогрессивное, на наш взгляд, положение ВОЗ о том, что специфические изменения психики у больных эпилепсией связаны не только с самим фактом заболевания, характером и частотой припадков, но и, главным образом, с локализацией и тяжестью эпилептогенного органического повреждения мозга, условиями жизни ребенка, отношением к его заболеванию в семье, наследственным фактором и др. Следует также отметить, что названные выше специфические нарушения психики определялись лишь у больных начиная со школьного возраста, а в дошкольном и в более младшем возрасте на фоне немногочисленных наблюдений с выраженной задержкой психического развития чаще регистрировались особенности поведения и эмоциональные реакции неспецифического типа, сравнимые с таковыми, встречающимися, например, у больных неврозами.
Изменения психики неспецифического характера обнаружены у 60% больных группы риска, наблюдались во всех возрастных группах и среди всех клинических разновидностей донозологических ЦП. В поведении таких детей выявлены две господствующие тенденции. Первая состояла в доминировании астенических проявлений у 25% больных. Дети жаловались на повышенную утомляемость при физических и умственных нагрузках, головные боли, нарушения сна. В их поведении отмечалась плаксивость, полярность эмоций, необоснованное упрямство и негативизм. У других 35% больных преобладала психомоторная расторможенность, гиперактивность, непоседливость, отсутствие дневного засыпания начиная с раннего возраста, трудная управляемость поведением дома, в детских учреждениях и в школе.
Кроме того, у 48% детей группы риска, общим фоном, на котором развивались выявленные в наших наблюдениях изменения психики, было легкое отставание в психомоторном развитии на первом году жизни и в преморбидном периоде, предшествующем развертыванию первых церебральных пароксизмов. Этот общий психомоторный фон и сами неспецифические изменения психики расценивались в качестве клинического выражения пре- перинатальной органической патологии мозга, как основного этиологического фактора ЦП у детей в наших наблюдениях.
Таким образом, нарушения психики в периоде донозологических проявлений эпилепсии у детей носили преимущественно неспецифический характер и состояли в изменениях поведения невротического типа. Они связывались нами не столько с имевшими место у этих детей единичными эпилептическими припадками или повторными атипичными неэпилептическими пароксизмами, но главным образом с легкими органическими повреждениями мозга, полученными преимущественно в периоде беременности, родов и условиями постнатальной жизни.
2.4. Течение, исход и продолжительность донозологических проявлений эпилепсии у детей.
Течение и исход донозологического периода эпилепсии в наших наблюдениях являлись неоднозначными и зависели не только от характера первых церебральных пароксизмов, но и от других факторов, имеющих тесное отношение к эпилептическому процессу. Важно подчеркнуть, что в настоящем исследовании, основным клиническим содержанием донозологического периода эпилепсии у детей являлись не только неэпилептические пароксизмы, которые в анамнезе больных эпилепсией находили многие авторы, но и сами впервые развертывающиеся эпилептические припадки. Конкретное прогностическое значение каждой разновидности церебральных пароксизмов, в определенных условиях заболевания и у конкретного больного не могло быть одинаковым. В двух предыдущих разделах настоящей главы исследовался лишь один, и в частности неблагоприятный вариант исхода церебральных пароксизмов в эпилепсию. Подобный крен в сторону неблагоприятного исхода ЦП у детей обусловлен спецификой настоящего издания, цель и задачи которого состояли в выделении донозологического периода заболевания у всех детей больных эпилепсией, но не в исследовании исхода всех первых церебральных пароксизмов у детей. Поэтому, было бы большой ошибкой полагать, что констатация у ребенка донозологической стадии эпилепсии всегда означала неизбежность заболевания его эпилепсией в будущем. Данный этап динамики заболевания означал для нас лишь пребывание больного в группе высокого риска по эпилепсии и рассматривался как промежуточный, но не окончательный исход первых церебральных пароксизмов у детей. Кроме эпилепсии важным вариантом исхода являлось прекращение припадков и возможность выздоровления ребенка.
По первому впечатлению, клиника и патофизиология эпилептических пароксизмов донозологического периода находятся в большей близости к клинике и патофизиологии манифестной стадии эпилепсии, по сравнению с неэпилептическими пароксизмами. Поэтому можно было бы предположить, что первые ЭП являются всегда прогностически более неблагоприятными в отношении выхода их в эпилепсию. Однако реальность состояла в том, что в донозологическом периоде заболевания как эпилептические припадки, так и атипично протекающие неэпилептические ЦП прогностически опасны не сами по себе, но лишь в сочетании с разнообразными факторами риска, лежащими часто вне характера пароксизмов.
Эпилептическая реакция, эпилептический синдром и спонтанные эпилептические припадки имели в наших наблюдениях оба принципиальных варианта исхода - исход в эпилепсию и прекращение припадков. При эпилептической реакции и первых спонтанных эпилептических припадках, основными факторами определяющими прекращение припадков являлась однократность пароксизмов. В условиях отсутствия провоцирующих воздействий и значимых факторов риска по эпилепсии, таких как пароксизмальная активность на ЭЭГ, грубые органические повреждения мозга в преморбидном периоде и наследственность, осложненная по эпилепсии, припадки чаще прекращались у детей с однократными пароксизмами и реже - при повторении их.
Так, например, из 28 больных второй группы наблюдений со спонтанными припадками у 17 они были единичными и у 11 - повторными. При общей продолжительности наблюдения в 3 года припадки рецидивировали у 60% больных с единичными и у 90% - с повторными припадками.
По данным литературы прекращение как единичных как и повторных фебрильных припадков отмечалось различными авторами от 4% до 96% наблюдений. Столь выраженные колебания показателя ремиссии можно объяснить малым количеством наблюдений в исследуемых группах, различием критериев принадлежности к простым и осложненным фебрильным припадкам, различной продолжительностью ремиссии по припадкам и др. К настоящему времени мы не располагаем подобными конкретными данными, например в процентном выражении. Однако под нашим наблюдением находятся 82 больных с фебрильными припадками и с продолжительностью ремиссии по припадкам до 10 лет, из которых у 51 больного припадки были единственными и у 31- повторными.
Частота прекращения припадков у больных судорожным синдромом периода новорожденности обнаруживала связь с возрастом больного и продолжительностью наблюдения. К концу первого месяца жизни судороги регрессировали у 55% больных, к З-х летнему возрасту – у 75%, и к 14 летнему у 80%. У остальных 20% больных наблюдали повторные припадки и исход в эпилепсию.
Исход эпилептического синдрома у больных перинатальной энцефалопатией оказался более тяжелым. Из 60 больных при продолжительности наблюдения до 3 лет практически здоровыми оказались лишь 8 детей. У остальных выявлены следующие исходы: эпилепсия - у 13 больных: детский церебральный паралич - у 5; детский церебральный паралич с эпилептическим синдромом - у 2; фебрильные припадки - у 12; аффективно-респираторные припадки - у 7; синдром девиантного поведения в виде психомоторной расторможенности без пароксизмов - у 3 и задержка психомоторного развития - у 3 больных [Миридонов В.Т., 1994].
Общая тенденция течения донозологического периода эпилепсии, проявляющегося эпилептическими припадками, состояла в том, что пароксизмы обнаруживали склонность к повторению и тем самым угрожали развитием эпилепсии у тех больных, которые являлись носителями значимых факторов риска по эпилепсии, названных выше и которые подвергались дополнительным провоцирующим воздействиям, например таким, как ушибы головы, инфекционные заболевания, протекающие с гипертермией, погрешности в проведении терапии АЭП и др. Следует, тем не менее отметить, что в наших наблюдениях всегда существовала возможность прекращения эпилептических припадков в донозологическом периоде эпилепсии и особенно при однократном их развертывании.
Однако, как видно из изложенного, прекращение эпилептических припадков в ДПЭ не всегда было эквивалентом выздоровления ребенка, но сопровождалось и другими, порой тяжелыми вариантами исхода, рассмотренными на примере течения эпилептического синдрома у больных пре- перинатальной энцефалопатией, Кроме того, здесь также имеется в виду исход в виде присоединения различных неэпилептических пароксизмов, появления психомоторной расторможенности в поведении ребенка, симптомов вегетативной дистонии, нарушений сна и бодрствования, нарушений эмоционального поведения и др. В целом все различные клинические варианты исхода у этих больных мы связывали не только и не столько с имевшимися в анамнезе единственными или немногочисленными эпилептическими припадками, но и прежде всего с пре- перинатальными органическими повреждениями мозга и другими патологическими факторами постнатальной жизни ребенка.
Неэпилептические пароксизмы имели в наших наблюдениях 4 основных варианта непосредственного исхода: прекращение приступов, повторное их развертывание, присоединение новых разновидностей неэпилептических пароксизмов и появление эпилептических припадков. Конкретные клинические модели переходного периода от неэпилептических пароксизмов к эпилептическим припадкам были разными для различных разновидностей неэпилептических пароксизмов и более того - являлись индивидуальными для каждого ребенка как это было показано выше на примере гипнических и аффективно-респираторных пароксизмов. Однако объединяющие всех этих больных факторы, создающие угрозу присоединения эпилептических припадков к повторно протекающим неэпилептическим пароксизмам были налицо: атипизм клинических проявлений и обстоятельств развертывания пароксизмов в сочетании с другими факторами риска, наиболее постоянными из которых являлись повторность пароксизмов, пароксизмальная активность на ЭЭГ и наследственный анамнез, осложненный по эпилепсии.
Другая особенность данного клинического варианта донозологического периода эпилепсии состояла в том, что неэпилептические пароксизмы не всегда прекращались с развертыванием первых эпилептических припадков, но продолжались и далее, сосуществуя с последними у 60% больных. Период параллельного развертывания неэпилептических и эпилептических пароксизмов, продолжался у разных больных от несколько месяцев до нескольких лет, после чего неэпилептические пароксизмы появлялись реже и затем прекращались. Жалобы больных на сосуществование в настоящее время неэпилептических и эпилептических пароксизмов обязывали углубить анамнестическое исследование у этих больных и, что давало возможность выявить наличие неэпилептических пароксизмов в периоде, предшествующем развертыванию первых эпилептических припадков. Это позволяло, в свою очередь, уточнить начало, клиническое содержание и продолжительность донозологического периода эпилепсии, а также косвенно указывало на относительно непродолжительную давность заболевания, поскольку в стадии развернутых клинических проявлений эпилепсии, при ее многолетнем течении, неэпилептические пароксизмы в наших наблюдениях встречались редко.
При исследовании продолжительности донозологического периода эпилепсии мы встретились с существенными трудностями, которые были обусловлены, главным образом, объективными причинами. Главная из них состояла в том, что период формирования или становления нозологической формы был выделен у всех больных эпилепсией впервые в эпилептологии и подобных исследований мы не обнаружили в доступной отечественной и зарубежной литературе. Естественное, поэтому, впервые вставал вопрос и о календарном исчислении продолжительности этого периода. Кроме того в настоящее время, критерии диагностики эпилепсии в качестве нозологической формы по данным литературы и имеющихся рекомендаций ВОЗ не являются настолько определенными, чтобы не допустить возможного субъективизма, тесно связанного с личным опытом врача. Задачи настоящего издания потребовали занять более определенную позицию и по этому крайне важному в практической эпилептологии вопросу, которая позволила бы вычислить продолжительность периода формирования эпилепсии.
В настоящем исследовании за продолжительность донозологического периода эпилепсии у детей мы принимали промежуток времени от первого в жизни ребенка церебрального пароксизма неэпилептического или эпилептического характера, до второго, а иногда и третьего неспровоцированного очевидными факторами (спонтанного) эпилептического припадка. При этом диагноз эпилепсии ставился только тогда, когда эти 2-3 спонтанных эпилептических припадка развертывались в одном возрастном периоде детства, за максимальную продолжительность которого мы приняли, в свою очередь, непрерывный период времени в течении 5 лет.
Продолжительность донозологического периода эпилепсии у конкретных больных колебалась от нескольких недель до нескольких лет. Перед нами же стояла задача определить среднюю величину этой продолжительности для того, чтобы очертить ею календарный срок проведения превентивной антиэпилептической терапии больным группы риска, которых расценивали как находящихся в донозологическом периоде эпилепсии. Единицей измерения избрали один календарный месяц. Среднюю продолжительность определяли раздельно для каждого из выделенных нами 4-х клинических вариантов донозологического периода эпилепсии: эпилептической реакции, эпилептического синдрома, спонтанных эпилептических припадков и атипично протекающих неэпилептических пароксизмов. Согласно стандартным приемам статистики, исключили из выборки крайние значения продолжительности. В нашем исследовании это были величины менее одного календарного месяца и более 5 лет.
Самая короткая продолжительность донозологического периода эпилепсии оказалась у больных спонтанными эпилептическими припадками и составило 7 ± 3 мес. У больных эпилептическим синдромом и эпилептической реакцией – соответственно 14 ± 3 мес, и 18 ± 4 мес. Среднюю продолжительность донозологического периода эпилепсии, с атипично протекающими неэпилептическими пароксизмами в анамнезе, стандартным приемом определить не удалось в связи с тем, что ошибка средней арифметической составляла более половины величины самой средней арифметической. Однако оказалось, что искомая величина в 24 мес и менее была выявлена у 62% соответствующих больных. Она и была условно принята за среднюю продолжительность донозологического периода у больных эпилепсией с атипично протекающими неэпилептическими пароксизмами в анамнезе. В целом, средняя длительность донозологического периода эпилепсии составляла в наших наблюдениях 1-2 года. В качестве же минимального срока превентивной антиконвульсантной терапии мы приняли 2 года после последнего пароксизма и увеличивали его лишь по индивидуальным показаниям.
Таким образом, главной особенностью донозологических проявлений эпилепсии у детей при спонтанном течении заболевания явилось развертывание рецидивирующих эпилептических припадков с конечным исходом в эпилепсию. Полученные результаты актуализировали выделение донозологического периода эпилепсии в качестве научной базы для последующего обоснования превентивной антиэпилептической терапии.
2.5. Факторы риска и основы прогнозирования эпилепсии у детей с церебральными пароксизмами.
Выделение донозологического периода эпилепсии у детей было направлено в наших исследованиях на достижение двух определенных целей. Первая состояла в том, чтобы вскрыть основное клиническое и ЭЭГ содержание этого периода и попытаться тем самым в определенной степени заполнить существующий до настоящего времени пробел в учении о формировании эпилепсии. Вторая цель имела более выраженное практическое, прикладное значение, состоявшее в том, чтобы использовать данный этап заболевания для разработки научного обоснования раннего, превентивного антиэпилептического лечения и следовательно, для профилактики манифестных, развернутых форм эпилепсии у детей, в лечении которых до настоящего времени врачи испытывают существенные, а порою непреодолимые трудности. Важной составной частью такого лечения должна стать антиконвульсантная терапия, назначаемая на период времени не меньший, чем средняя продолжительность донозологического периода заболевания. Постоянный и непрерывный прием АЭП, хотя и в профилактических дозах, но в течение нескольких лет и в условиях отсутствия диагноза эпилепсии, потребовал научного обоснования. Так появилась необходимость в прогнозировании эпилепсии у детей страдающих церебральными пароксизмами, в выделении значимых факторов риска по эпилепсии, в поиске их опасных сочетаний и формировании группы риска, состоящей из больных, находящихся в донозологическом периоде заболевания.
Прежде всего, предстояло выделить факторы риска по эпилепсии, к характеру которых были предъявлены определенные требования. Было ясно, что кроме непременной высокой значимости, они должны были быть немногочисленными, носить преимущественно клинический характер и быть удобными для повседневной практической деятельности врача. Для того, чтобы факторы риска приобрели эталонное значение, они были выделены посредством анализа заболевания у больных с бесспорным диагнозом эпилепсии, находящейся в периоде развернутых клинических и ЭЭГ проявлений, т.е. у больных прошедших донозологический период заболевания и не миновавших его.
Непременным условием начала прогнозирования эпилепсии считали наличие у ребенка хотя бы одного перенесенного церебрального пароксизма, а обоснованием начала превентивной антиэпилептической терапии - соответствие признаков заболевания выделенным критериям ДПЭ.
В начале исследования определили основные признаки заболевания, которые можно было обнаружить у многих, большинства или у всех больных с развернутым клиническим вариантом эпилепсии и которые мы назвали маркерами эпилепсии. За основные маркеры эпилепсии приняли следующие: повторный характер пароксизмов, пароксизмальную (типичную эпилептическую и условно эпилептическую) активность на ЭЭГ, органическое повреждение мозга по данным анамнеза или комплексного объективного обследования возраст начала церебральных пароксизмов моложе 7 лет, нарушения психики специфического типа, отставание в психомоторном развитии в преморбидном периоде, малые аномалии развития в количестве 5 и более, наследственный анамнез, осложненный по эпилепсии и другим ЦП.
При анализе динамики пароксизмального синдрома у больных эпилепсией с неэпилептическими ЦП и фебрильными припадками в анамнезе был выделен еще один важный маркер, ставший впоследствии фактором риска по эпилепсии высокой значимости, который получил название атипизма клинических проявлений и обстоятельств развертывания донозологических ЦП и который обнаруживался, чаще при их повторении. Он состоял в том, что ЦП, будучи в начале типичными неэпилептическими или типичными фебрильными припадками, постепенно, от приступа к приступу, утрачивали традиционную специфичность, и по своим клиническим проявлениям и обстоятельствам развертывания приближались к эпилептическим припадкам. Признаки клинической атипичности были специфичными для каждой клинической разновидности неэпилептических пароксизмов, проявлялись индивидуально у каждого больного и были изложены во втором разделе настоящей главы.
Следующим этапом исследования явился поиск значимых факторов риска по эпилепсии посредством «наложения» избранных маркеров на историю заболевания конкретного ребенка, больного эпилепсией, находящейся в развернутой стадии своего развития. Прежде всего нас интересовали те маркеры эпилепсии, которые могли быть обнаружены уже при первых церебральных пароксизмах у детей. Оказалось, что именно они встречались особенно часто и обнаруживались в количестве не менее двух у каждого больного эпилепсией. Этими маркерами были следующие: наличие пароксизмов, пароксизмальная активность на ЭЭГ и наследственный анамнез, осложненный по эпилепсии. Мы назвали эти маркеры факторами риска по эпилепсии высокой значимости. Кроме того при эпилептическом характере первых пароксизмов факторами риска высокой значимости оказались также однократный пароксизм и перенесенное органическое повреждение мозга по данным анамнеза или комплексного объективного исследования.
Таким образом, у детей больных эпилепсией, с учетом основных клинических вариантов начала и процесса формирования заболевания, выделены 6 факторов риска высокой значимости, которые приобрели в наших исследованиях эталонное значение. Два из них оказались общими для всех больных: наследственный анамнез, осложненный по эпилепсии и пароксизмальная активность на ЭЭГ. Еще два являлись специфичными для больных эпилептическими припадками: однократный пароксизм и перенесенное, либо текущее органическое заболевание мозга и последние два – для детей с неэпилептическими пароксизмами: повторный характер пароксизмов и атипизм их клиники и обстоятельств развертывания.
Следует отметить, что такие факторы риска, как перенесенное органическое повреждение мозга, наследственный анамнез, осложненный по эпилепсии и другим церебральным пароксизмам и пароксизмальную активность на ЭЭГ, мы находили не только у больных с различными ЦП, но и при другой многочисленной неврологической патологии, а по данным литературы, некоторые из выделенных нами выше маркеров эпилепсии можно встретить и у здоровых детей, которые, при учете у них этих маркеров и факторов риска, становились бы, в известной степени, более угрожаемыми по заболеванию эпилепсией, чем остальные дети в популяции. Но это означало бы попытку прогнозирования эпилепсии у детей, личный анамнез которых оказывался свободным от каких-либо ЦП и даже у детей на фоне полного клинического здоровья. Практически исходом такого прогнозирования могло бы быть принятие определенных профилактических мер, в том, числе и постановка вопроса о превентивном антиэпилептическом лечении практически здоровым детям.
Мы не могли пойти по этому пути. Для нас было ясно, что донозологический период эпилепсии является безусловно патологическим состоянием, требующим лечебной коррекции. Более того, он оказался заполненным теми же основными клиническими синдромами, что и манифестная стадия заболевания, находящимися, однако, не в своем конечном, сформированном состоянии, но в процессе динамики, начиная от первых церебральных пароксизмов, которые у многих детей могут регрессировать без лечения, при своем спонтанном течении, до устойчивого патологического состояния, знаменующего собой манифестные проявления эпилепсии. Практическая же направленность настоящего исследования состояла в том, что бы не предоставлять донозологический период эпилепсии своему естественному, спонтанному течению, но обосновать необходимость превентивного антиэпилептического лечения больным группы риска.
В соответствии с целью и задачами исследования реальное прогнозирование эпилепсии мы начинали немедленно после первого в жизни ребенка эпилептического припадка или после повторных неэпилептических пароксизмов, посредством поиска у этих больных значимых факторов риска по эпилепсии и формирования группы риска по этому заболеванию. В группу риска по эпилепсии помещали тех детей, которые обладали не менее чем двумя факторами риска по эпилепсии высокой значимости в любых сочетаниях, названных нами опасными сочетаниями. Принципиальную схему этого процесса иллюстрирует рисунок 10, из которого видно, что для прогнозирования эпилепсии у конкретного больного и определения его принадлежности к группе риска оказывался достаточным набор лишь из 4
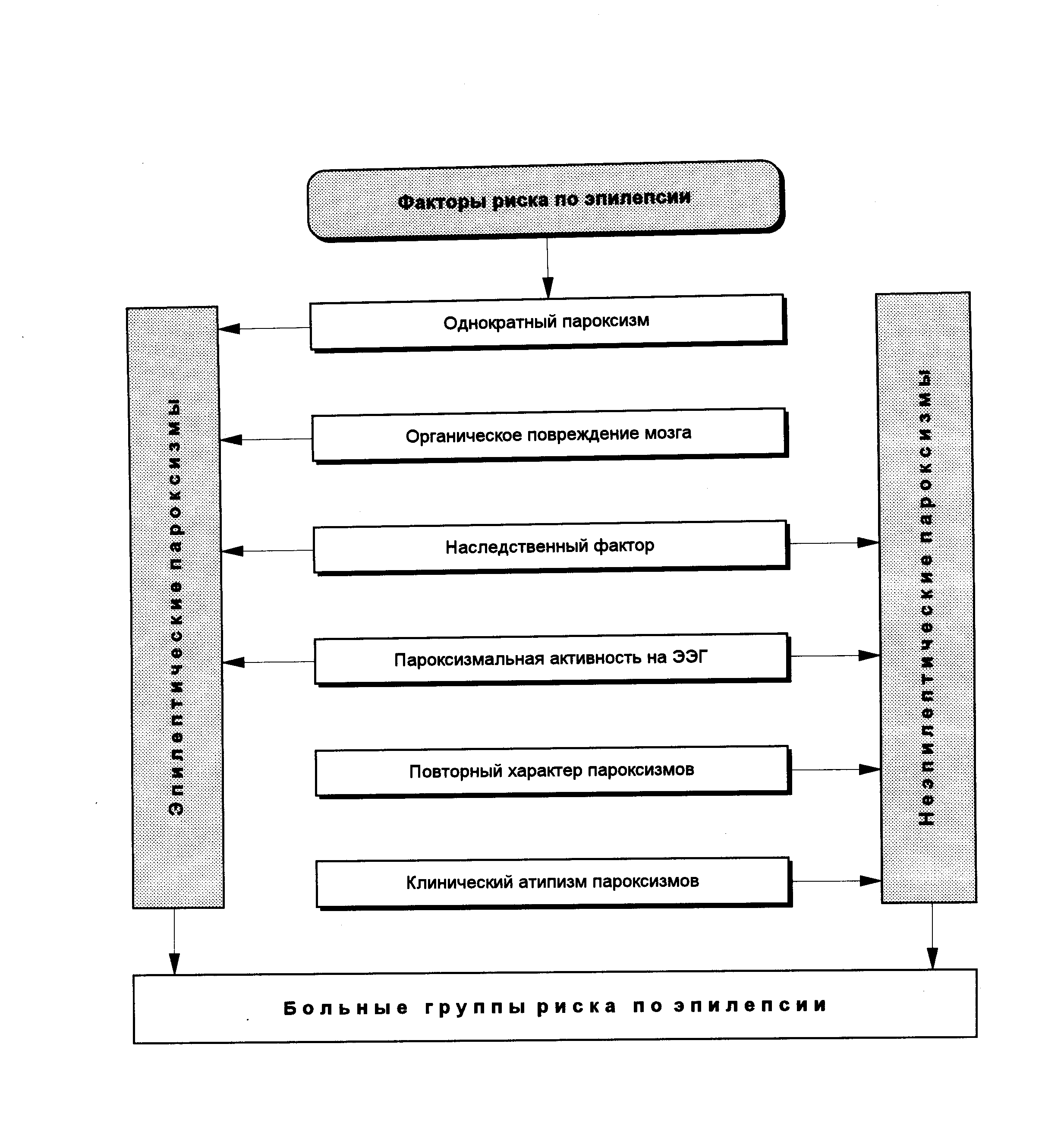

Рисунок 11. Общая клиническая структура больных группы риска по эпилепсии
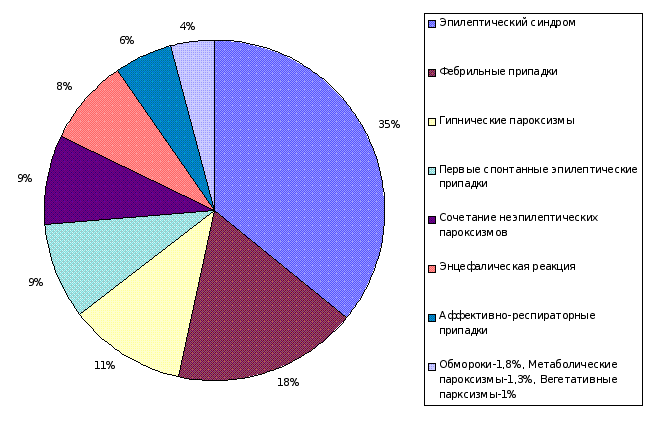
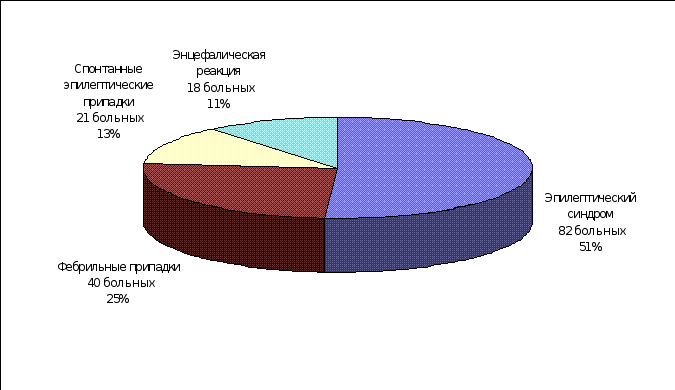
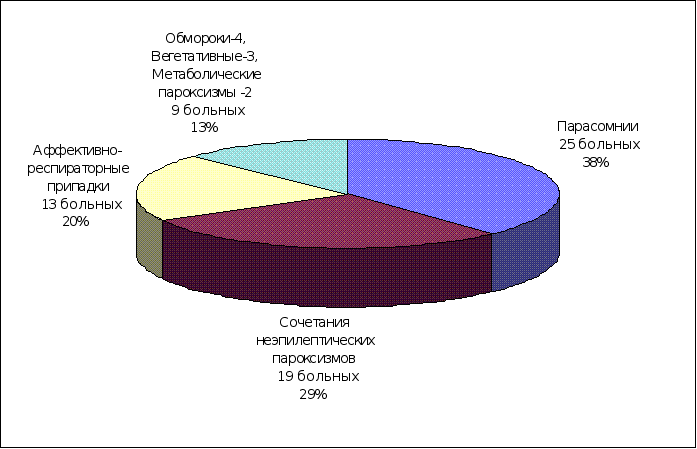
Рисунок 14. Рубрификация и количество первых неэпилептических пароксизмов составивших группу риска по эпилепсии
66 больных (100% наблюдений)
Таблица 6. Клиническая структура церебральных пароксизмов и количество больных второй группы наблюдений, составивших группу риска по эпилепсии.
|
пп |
Наименование пароксизмов | Количество больных | % |
| 1 | Эпилептический синдром | 82 | 36,0 |
| 2 | Фебрильные припадки | 40 | 17,6 |
| 3 | Парасомнии | 25 | 11,0 |
| 4 | Спонтанные эпилептические припадки | 21 | 9,3 |
| 5 | Сочетание неэпилептических пароксизмов | 19 | 8,3 |
| 6 | Энцефалическая реакция | 18 | 8,0 |
| 7 | Аффективно-респираторные припадки | 13 | 5,7 |
| 8 | Обмороки | 4 | 1,8 |
| 9 | Вегетативные пароксизмы | 3 | 1,3 |
| 10 | Метаболические пароксизмы | 2 | 1,0 |
| Всего | 227 | 100 |
факторов риска высокой значимости, причем содержание этого набора зависело от характера донозологических ЦП. Так, при первых пароксизмах эпилептического характера факторами риска высокой значимости являлись: однократный эпилептический припадок, органическое повреждение мозга, выявленное по результатам комплексного обследования больного, пароксизмальная активность на ЭЭГ и наследственный анамнез, осложненный по эпилепсии. При неэпилептическом характере пароксизмов в набор факторов риска высокой значимости входили следующие: повторность пароксизмов, наследственный анамнез, осложненный по эпилепсии, пароксизмальная активность на ЭЭГ и атипизм клинических проявлений и обстоятельств развертывания пароксизмов.
Всего в группу риска вошли 277 больных (43%) второй группы наблюдений, которые расценивались как находящиеся в донозологическом периоде заболевания. Клиническая структура, количественный состав и удельный вес донозологических пароксизмов, составивших группу риска по эпилепсии представлены на рисунках 11,12,13,14 и таблице 6, из которых видно, что господствующее положение в группе риска заняли больные с эпилептическим синдромом и фебрильными припадками, а из группы неэпилептических пароксизмов - больные парасомниями.
Степень угрозы выхода различных групп донозологических пароксизмов в эпилепсию иллюстрирована на рисунках 15,16.
По нашим данным из 240 детей с первыми эпилептическими припадками в группу риска по эпилепсии вошли 161, что составило 66,6 наблюдений группы риска или 30,5% от всего количества больных второй группы. Среди них наиболее угрожаемыми по развитию эпилепсии являлись больные эпилептическим синдромом (100%) в связи с тем, что все они кроме единичных эпилептических припадков обладали и вторым фактором риска по эпилепсии высокой значимости, а именно текущим органическим заболеванием мозга. Последующие позиции по степени угрозы выхода в эпилепсию занимали дети перенесшие однократный спонтанный эпилептический припадок, энцефалическую реакцию и больные фебрильными припадками (рисунок 15).
У остальных больных с единичными эпилептическими припадками, диагностированными вне рамок эпилепсии, не обнаружено других значимых факторов риска, поэтому они расценивались как менее угрожаемые по этому заболеванию в данный момент времени. Среди них основное количество наблюдений составили 64 больных с фебрильными припадками. Значительно меньше было больных энцефалической реакцией (8) у детей, перенесших единственный спонтанный эпилептический припадок (7).
Из 290 больных с неэпилептическими пароксизмами в группу риска по эпилепсии вошли 66, что составило 33,4% наблюдений группы риска или 12,5% от общего количества наблюдений второй группы. Как видно из таблицы 6. основное количество этих наблюдений составили дети с парасомниями (25), сочетанием нескольких разновидностей неэпилептических пароксизмов (19) и аффективно-респираторными припадками (13). Рисунок 16. иллюстрирует степень угрозы выхода в эпилепсию отдельных клинических форм неэпилептических пароксизмов в наших наблюдениях. Так, наиболее угрожаемыми по эпилепсии являлись больные с сочетанием нескольких разновидностей неэпилептических пароксизмов. Вторую и последующие позиции заняли больные парасомниями, аффективно-респираторными припадками. Что касается данных о весьма высокой степени угрозы по выходу в эпилепсию метаболических, вегетативных и обморочных пароксизмов, то мы не могли их переоценивать в связи с общей малочисленностью названных подгрупп больных.
Таким образом, в наших наблюдениях абсолютное большинство больных неэпилептическими ЦП не являлись угрожаемыми по эпилепсии в данный момент времени. Это были дети с однократными, реже с повторными неэпилептическими пароксизмами, не обладавшие другими значимыми факторами риска по эпилепсии: пароксизмальной активностью на ЭЭГ, наследственным анамнезом, осложненным по эпилепсии и атипизмом клинических проявлений и обстоятельств развертывания повторных неэпилептических пароксизмов.
Следует однако отметить, что приведенные результаты прогнозирования эпилепсии в наших наблюдениях получены при однократном исследовании и являются в значительной мере статичными. Тем не менее, одну из существенных задач настоящего издания мы считали решенной, поскольку оказалась разработанной сама методика прогнозирования эпилепсии на стадии ее донозологических проявлений. Эта методика является базой врача необходимой для последующего обоснования превентивного антиэпилептического лечения больных группы риска и может быть повторена неоднократно в процессе динамического наблюдения за больным. По результатам такого наблюдения и повторного прогнозирования исхода заболевания, конкретный состав больных, находящихся в группе риска по эпилепсии будет неизбежно и постоянно колебаться. Основные направления этих перемещений больных, осуществляемых врачом в группе риска излагаются ниже. В заключение настоящего раздела следует отметить основные принципы прогнозирования вероятного развития эпилепсии в наших наблюдениях: простота, преимущественно клинический характер, что позволяет
Рисунок 15. Степень риска по формированию эпилепсии у больных первыми эпилептическими припадками
широко использовать разработанную методику в практическом здравоохранении, профилактическая направленность, унифицированность методики, основанной на выделении единых факторов риска для больных с любой клинической разновидностью донозологических ЦП и в то же время – сохранность дифференцированного подхода, учитывающего их характер.
Таким образом, результаты исследования, изложенные в настоящей главе позволяют заключить, что основными клиническими проявлениями донозологического периода эпилепсии у детей является пароксизмальный синдром и нарушения психики. Синдром церебральных пароксизмов был представлен единичными эпилептическими припадками, которым у 34% больных предшествовали повторные, атипично протекавшие неэпилептические пароксизмы. Синдром психических нарушений состоял в неспецифических изменениях поведения детей по невротическому типу. По нашим данным, единичные эпилептические припадки и повторные неэпилептические пароксизмы уже сами по себе являются значимыми факторами риска, однако эпилепсией заболевают лишь те дети, которые оказываются носителями и других факторов риска в опасных сочетаниях: атипизма и клинической тяжести пароксизмов, перенесенного ранее или актуального в настоящее время органического повреждения мозга, пароксизмальной активности на ЭЭГ и наследственности, осложненной по эпилепсии. Исследование показало, что формирование состоявшихся, обоснованно диагностированных клинических форм эпилепсии поддается прогнозированию в периоде донозологических проявлений заболевания, средняя продолжительность которого составляет 1-2 года.
ГЛАВА 3. ПАТОФИЗИОЛОГИЯ ДОНОЗОЛОГИЧЕСКИХ ПРОЯВЛЕНИЙ У ДЕТЕЙ.
3.1. Анализ результатов электроэнцефалографического исследования больных группы риска по эпилепсии
В группу риска по эпилепсии вошли 227 больных второй группы наблюдений, из которых у 161 (71%) отмечались единичные эпилептические припадки и у 66 (29%) – повторные, атипично протекающие неэпилептические ЦП (рис. 11. и табл. 6.). Все эти больные являлись носителями опасных сочетаний значимых факторов риска и заболевание у них расценивалось как находящееся в донозологическом периоде эпилепсии.
Результаты ЭЭГ исследования больных группы риска рубрифицированы на варианты возрастной нормы и патологические изменения. В свою очередь патологические ЭЭГ изменения, подразделяли на постоянные и пароксизмальные. Из таблицы 7. и рис. 17 видно, что ЭЭГ была патологически изменена у 190 больных группы риска, что составило 84% наблюдений. У остальных 37 больных (16%) данные ЭЭГ представляли собой варианты возрастной нормы. Среди патологических изменений у 158 больных (70%) выявлялась постоянная патологическая активность и у 152 (67%) - пароксизмальная.
За постоянную патологическую активность принимали аномальные биопотенциалы следующие непрерывно, либо сгруппированные в более или менее отчетливые разряды (вспышки), локализовавшиеся в отдельных или нескольких отведениях, либо имеющих преимущественно генерализованный и двухсторонний характер. При этом, согласно терминологическому словарю Международной федерации обществ электроэнцефалографистов (1974) различали ЭЭГ разряды и ЭЭГ пароксизмы. Под ЭЭГ разрядами или вспышками понимали группу однородных потенциалов существенно отличавшихся от фоновой активности по своей форме, частоте и амплитуде, однако, в отличие от ЭЭГ пароксизма, появлявшихся и исчезавших более или менее постепенно, но не внезапно, и регистрировавшихся в течение различного, порою весьма продолжительного периода времени. Разряд патологической активности никогда не сопровождался никакими преходящими клиническими проявлениями.
Таблица 7. Общие результаты ЭЭГ исследований больных группы риска по эпилепсии.
|
пп |
Характер ЭЭГ данных | Количество больных | % |
| 1 | Вариант возрастной нормы | 37 | 16 |
| 2 | Постоянная патологическая активность | 158 | 70 |
| 3 | Пароксизмальная патологическая активность | 152 | 67 |
| 4 | Всего больных с патологическими изменениями на ЭЭГ | 190 | 84 |
| 5 | Общее количество больных группы риска | 227 | 100 |
Таблица 8. Постоянная патологическая ЭЭГ активность в донозологическом периоде эпилепсии у детей.
|
пп |
Характер патологической активности | Количество больных | % |
| 1 | Медленная дельта активность | 27 | 11,5 |
| 2 | Медленная тета активность | 32 | 15,0 |
| 3 | Сочетание медленной дельта и тета активности | 54 | 23,0 |
| 4 | Запаздывание электрогенеза в сочетании с медленной активностью | 27 | 11,5 |
| 5 | Изолированное запаздывание церебрального электрогенеза | 18 | 9,0 |
| 6 | Всего больных с постоянной патологической ЭЭГ активностью | 158 | 70,0 |
| 7 | Количество больных группы риска без постоянной патологической ЭЭГ активности | 69 | 30,0 |
| 8 | Общее количество больных группы риска по эпилепсии | 227 | 100 |
227 больных (100% наблюдений).
По данным современных отечественных и зарубежных исследователей постоянные патологические ЭЭГ изменения имеют непосредственную связь с актуальными органическими повреждениями мозга и его важнейших анатомо-функциональных систем или резидуальными явлениями такого повреждения. В клинической электроэнцефалографии выделяют семь основных групп постоянной патологической активности: депрессию церебрального электрогенеза, быструю патологическую активность, медленные трехфазные волны, гипсаритмию, медленную тета-активность, медленную дельта-активность и запаздывание церебрального электрогенеза. Первые четыре разновидности были исключены из рассмотрения потому, что не являлись актуальными в донозологическом периоде эпилепсии по определенным причинам.
Так например, генерализованная депрессия церебрального электрогенеза представляет собой значительное снижение вольтажа биопотенциалов, выраженное уплощение ЭЭГ вплоть до изоэлектрической линии. Постоянная генерализованная депрессия по типу тотального биоэлектрического «молчания» характерна для крайне тяжелого общего состояния больного и регистрируется чаще всего в отделениях реанимации у больных находящихся в состоянии клинической смерти. Преходящая генерализованная депрессия церебрального электрогенеза характерна для коматозного состояния различной степени выраженности и встречается, например, у больных находящихся в острейшем периоде инсульта, при тяжелой черепно-мозговой травме, эпилептическом статусе и др. Депрессию электрогенеза локального типа чаще всего наблюдают при обширных очаговых повреждениях мозга - опухолях больших полушарий, кистах, внутричерепных гематомах.
Быстрая постоянная патологическая активность характеризуется ритмом потенциалов высокой амплитуды - до 50-150 мкВ и высокой частоты - до 15-25 в 1 сек. Встречается редко и описывается у детей первых дней жизни перенесших внутричерепную родовую травму.
Медленные трехфазные волны состоят из трех основных графических компонентов, альтернирующих относительно изоэлектрической линии с максимальной амплитудой до 200-300 мкВ. Первый компонент представляет собой острую волну, второй - медленную волну с вершиной, направленной в противоположную от первого компонента столону и третий - пик или медленную волну с вершиной обращенной в сторону первого компонента. Средняя частота таких трехфазных комплексов составляет 2-3 в 1 сек. Медленные трехфазные волны чаще всего находят у больных с коматозным состоянием, вызванным преимущественно энцефалопатиями дисметаболического происхождения, связанными с патологией внутренних органов, например, при несостоятельности порто-кавального кровообращения, при печеночной коме и др.
Гипсаритмия представляет собой непрерывно следующую во всех ЭЭГ отведениях полиморфную патологическую активность представленную пиками, острыми волнами, медленными волнами, комплексами пик-волна и острая волна - медленная волна очень высокой амплитуды, достигающей 300-500 мкВ. Гипсаритмия является специфичной для синдрома Веста - одного из манифестных злокачественных вариантов эпилепсии детей грудного возраста.
Последние три разновидности постоянной патологической ЭЭГ активности связываются преимущественно с восстановительным периодом и периодом резидуальных явлений органического повреждения мозга. Они являлись одним из существенных ЭЭГ проявлений донозологического периода эпилепсии и имели прямое отношение к его патофизиологии. В наших наблюдениях основным этиологическим фактором как завершенных клинически, так и донозологических проявлений эпилепсии являлись органические повреждения мозга, полученные, главным образом, в периоде беременности и родов, а сами больные находились в восстановительном периоде, либо в периоде резидуальных явлений такого повреждения. Кроме того, оказалось, что анализируемые ниже разновидности постоянной патологической активности имели и определенное топико-диагностическое значение, а именно указывали на органическое повреждение и нарушение функционального состояния срединных структур мозга. Количественные соотношения и удельный вес основных разновидностей постоянной патологической ЭЭГ активности в донозологическом периоде эпилепсии у детей иллюстрирует таблица 8.
Медленная дельта мономорфная активность билатерального и синхронного типа зарегистрирована у 11,5% больных группы риска. Она локализовалась преимущественно в отведениях от передних и реже средних отделов полушарий, имела ровную синусоидальную конфигурацию и при частоте составлявшей менее 4 колебаний в 1 сек. группировалась в весьма продолжительные, часто повторяющиеся разряды. Нередко подобные разряды принимали веретенообразную форму с относительно развернутым во времени началом и окончанием. В условиях отсутствия у наших больных острой стадии текущего органического повреждения мозга, постоянная, медленная, билатеральная, дельта мономорфная активность свидетельствовала о перенесенном ранее органическом повреждении и нарушении электрогенетической функции структур средней линии мозга: орбитальной лобной коры, медиальной лобной и теменной коры, окружающей колено и центральную часть мозолистого тела, промежуточного мозга с преимущественной дисфункцией таламуса, и ретикулярной формации оральных отделов ствола головного мозга [Gastaut H. et al., 1980]. Следует отметить, что при органическом повреждении большинства из этих структур, последние могут передавать, отражать мономорфную дельта активность на скальповые отведения от передних и средних отделов больших полушарий. Названные структуры лимбико-ретикулярного комплекса являются, таким образом, истинными пейсмекерами данной разновидности постоянной патологической активности, а сами веретена дельта мономорфного ритма следует считать переданными, отраженными, ритмами на дистанции.
Постоянная медленная тета-активность выявлена у 15% больных группы риска и представлена регулярным ритмом, состоящим из волн приближающихся к синусоидальному типу, амплитудой до 50-60 мкВ, следующих с частотой 4-6 колебаний в 1 сек. Тета-активность носила билатеральный синхронный, симметричный характер и регистрировалась преимущественно от средних отделов полушарий в центральных, теменных и височных отведениях и чаше всего с акцентом от передних отделов височной доли. Общее топико-диагностическое значение тета активности состояло в том, что она указывала на органическое повреждение или дисфункцию мезо-диэнцефальных структур мозга. Что касается ее акцента в передних височных отведениях, то по мнению некоторых авторов [Gastaut Н., Gastaut J-L., 1980], этот факт можно связать с повреждением медиобазальных структур непосредственно височной доли по типу инцизурального сидероза, описанного Пенфилдом и Фолкнером. По данным тех же авторов, смещение тета-активности преимущественно в теменные отведения, может указывать на перенесенное органическое повреждение тканей, расположенных вокруг стенок третьего желудочка мозга.
Следует отметить, что изолированная медленная активность представленная только ритмом дельта или тета диапазона выделялась с известной долей условности, поскольку более чем в половине наблюдений эти разновидности медленной активности в различной степени сочетались друг с другом. Количество наблюдений с сочетанием дельта и тета медленной активности составило 23% больных группы риска. В этих случаях не представлялось возможным выделить с определенностью доминирующий тип медленной активности. Что касается топико-диагностического значения сочетанных вариантов медленной постоянной дельта и тета активности, то оно оставалось прежним, изложенным выше.
Задержка церебрального электрогенеза или ЭЭГ признаки функциональной незрелости мозга обнаружены у 20,5% больных группы риска, причем у 11,5% они сочетались с патологической медленной активностью и у 9% больных зарегистрированы в изолированном виде. Основными ЭЭГ признаками функциональной незрелости мозга в наших наблюдениях являлись следующие: возрастное запаздывание формирования основных физиологических ЭЭГ ритмов, нарушение их нормального топографо-анатомического распределения, фрагментарная картина или «осколки» альфа ритма в отведениях от задних отделов полушарий, существенное нарушение синфазности потенциалов правого и левого полушарий мозга, запаздывание формирования зональных различий на ЭЭГ, слабая реактивность на функциональные пробы, например, недостаточная выраженность синхронизации потенциалов в ответ на гипервентиляцию или полное отсутствие реакции усвоения ритма на триггерную ритмичную фотостимуляцию и др.
Происхождение ЭЭГ феноменов, свидетельствующих о запаздывании церебрального электрогенеза, связывали с органическим повреждением мозга полученным, главным образом, в периоде беременности и родов, а так же с фактором недоношенности. Топико-диагностический аспект запаздывания церебрального электрогенеза оставался прежним. Его считали обусловленным повреждением и дисфункцией глубинных структур мозга, а также замедленным, по сравнению с нормой, формированием структур корковых полей и их связей с основными узлами лимбико-ретикулярного комплекса.
Пароксизмальную активность на ЭЭГ идентифицировали в соответствии с рекомендациями Международного сообщества электроэнцефалографистов. Согласно выше упомянутому словарю терминов рекомендуемых к применению в клинической электроэнцефалографии под пароксизмом следует понимать простые или сложные по конфигурации графоэлементы ЭЭГ с внезапным и очень быстрым началом и окончанием, стремительно достигающие своей максимальной амплитуды и которые в силу этих свойств существенно отличаются от фоновой активности. Основными элементами пароксизмальной активности считали следующие: пики, полипики, острые волны, комплексы пик-волна, полипик-волна, острая волна – медленная волна.
К условно-эпилептической активности относили одиночные пики или острые волны, комплексы острая волна – медленная волна, а также гиперсинхронный, заостренный по форме альфа ритм, гиперсинхронный бета ритм и пароксизмально появляющиеся вспышки высокоамплитудных волн альфа, бета, тета или дельта диапазона.
Эпилептическая и условно-эпилептическая активность носила очаговый характер, если регистрировалась в одном или нескольких ЭЭГ отведениях от одного полушария, либо от одного-двух симметричных отведений обоих полушарий. К генерализованной активности относили пароксизмальную активность регистрирующуюся одновременно во всех отведениях от обоих полушарий.
В таблице 9. представлены сводные данные о пароксизмальной патологической ЭЭГ активности, полученной у 152 больных группы риска по эпилепсии, что составляло 67% наблюдений от общего числа больных группы риска. Во всех этих наблюдениях данные ЭЭГ расценивались в качестве фактора риска по эпилепсии высокой значимости. Из таблицы видно, что типичная эпилептическая активность у больных группы риска не являлась большой редкостью и обнаружена у 9% больных. Доминирующим же типом пароксизмальной активности в донозологическом периоде эпилепсии у детей являлась условно-эпилептическая активность, обнаруженная у 58% больных группы риска.
Из данных таблицы 10. следует, что типичная эпилептическая и условно-эпилептическая ЭЭГ активность распределилась неравномерно между двумя основными группами больных донозологического периода эпилепсии. Так, все 20 наблюдений с типичной эпилептической активностью на ЭЭГ оказались в группе больных с эпилептическим характером донозологических церебральных пароксизмов. Что касается условно-эпилептической активности, то ее частота оказалась в два раза выше у больных с эпилептическими донозологическими пароксизмами по сравнению с больными группы риска, являющимися носителями повторных атипично протекающих неэпилептических пароксизмов.
Следует также отметить, что внутри как типичной эпилептической, так и условно-эпилептической активности не обнаружено существенной разницы по частоте встречаемости между очаговым и генерализованным ее характером. С известной осторожностью этот факт можно истолковать так, что в донозологическом периоде эпилепсии наблюдалась примерно одинаковая потенциальная возможность проявления манифестных форм заболевания как парциальными, так и генерализованными эпилептическими припадками. Однако в связи с тем, что впервой группе наших наблюдений отмечалось явное преобладание клинических вариантов эпилепсии проявлявшейся Таблица 9. Пароксизмальна патологическая ЭЭГ активность у больных группы риска по эпилепсии.
|
пп |
Характер пароксизмальной патологической активности | Количество больных | % |
| 1 | Очаговая типичная эпилептическая активность | 9 | 4,0 |
| 2 | Генерализованная типичная эпилептическая активность | 11 | 5,0 |
| 3 | Очаговая условно-эпилептическая активность | 68 | 30,0 |
| 4 | Генерализованная условно-эпилептическая активность | 64 | 28,0 |
| 5 | Всего больных с пароксизмальной эпилептической активностью | 152 | 67,0 |
| 6 | Количество больных группы риска без пароксизмальной активности на ЭЭГ | 75 |
33,0 |
| 7 | Общее количество больных группы риска по эпилепсии | 227 | 100 |
Таблица 10. Пароксизмальная патологическая активность у больных группы риска по эпилепсии в зависимости от характера донозологических ЦП
|
пп |
Характер пароксизмальной активности | Единичные эпилептические припадки | Повторные эпилептические пароксизмы | ||
| количество больных | % | количество больных | % | ||
| 1 | Очаговая типичная эпилептическая активность | 9 | 4,0 | – | – |
| 2 | Генерализованная типичная эпилептическая активность | 11 | 5,0 | – | – |
| 3 | Очаговая условно-эпилептическая активность | 48 | 21,0 | 20 | 9,0 |
| 4 | Генерализованная условно-эпилептическая активность | 41 | 18,0 | 23 | 10,0 |
| 5 | Пароксизмальной активности не выявлено | 52 | 23,0 | 23 | 10,0 |
| 6 | Всего больных, вошедших в группу риска | 161 | 71,0 | 66 | 29,0 |
| 7 | Общее количество больных группы риска | 227 | 100 | 227 | 100 |
генерализованными эпилептическими припадками, можно лишь предположить, что по данным ЭЭГ в своем донозологическом периоде эпилепсия у детей чаще бывает парциальной или фокальной, чем в стадии развернутых проявлений заболевания.
Кроме того, частота встречаемости типичной эпилептической и условной эпилептической активности не зависели от характера рубрификации первых эпилептических припадков или клинической разновидности неэпилептических пароксизмов донозологического периода. Из этой господствующей тенденции выявлено лишь одно исключение состоящее в том, что из 9 больных с очаговой эпилептической активностью, 6 относились к подгруппе больных с эпилептическим синдромом. В целом же эта тенденция означала, что с ЭЭГ позиций первые эпилептические припадки представляли собой одинаковую степень угрозы выхода заболевания в эпилепсию, вне зависимости от обстоятельств их появления и клинической рубрификации, хотя по совокупности клинических данных наиболее угрожаемыми по формированию эпилепсии являлись больные эпилептическим синдром. Подобная же ситуация складывалась и в группе неэпилептических пароксизмов в целом, хотя по общей совокупности факторов риска наиболее опасными по угрозе выхода в эпилепсию являлись повторные атипично протекающие парасомнии. Таким образом, полученные данные свидетельствуют о том, что у детей ЭЭГ фактор риска по эпилепсии несколько уступает по своей прогностической значимости всей совокупности клинических факторов риска, по крайней мере у больных с названным выше характером донозологических церебральных пароксизмов.
В настоящем исследовании, наряду с традиционным диагностическим, дифференциально-диагностическим и прогностическим значением, результаты ЭЭГ исследования использовались и для понимания патофизиологии донозологического периода эпилепсии у детей.
Из таблицы 11 и рисунка 18, следует, что у 37 больных ЭЭГ представляла собой возрастную норму. Из них у 23 больных клиническая картина заболевания была представлена повторными атипично протекающими неэпилептическими пароксизмами и у 14 - единичными эпилептическими припадками. В отсутствие патологических изменений на ЭЭГ эти больные были помещены в группу риска по эпилепсии на основании опасных сочетаний других факторов риска высокой значимости в количестве не менее двух: эпилептического характера единичных припадков, повторного развертывания атипичных неэпилептических пароксизмов, органического повреждения мозга в анамнезе или выявленного по результатам комплексного обследования и наследственного анамнеза, осложненного по эпилепсии. Сам факт наличия в группе риска больных с неизмененной ЭЭГ позволял сделать три предварительных вывода. Первый из них состоял в том, что ЭЭГ фактор риска не являлся строго обязательным у всех больных в донозологическом периоде эпилепсии. Во-вторых, рождение ребенка в условиях действия факторов риска по пре- перинатальной патологии мозга и даже наличие клинически диагностированных вариантов перинатальной энцефалопатии не всегда имели прямые корреляты с патологическими ЭЭГ изменениями. И наконец, необходимо было допустить, что не только повторные атипичные неэпилептические пароксизмы, но и единичные эпилептические припадки могут развертываться на фоне конституционального, физиологического уровня пароксизмальной готовности мозга.
У 38 больных группы риска донозологические пароксизмы эпилептического и неэпилептического характера развертывались в условиях
отсутствия ЭЭГ признаков пароксизмальной активности, но на фоне постоянных патологических ЭЭГ изменений, свидетельствовавших об органическом повреждении глубинных структур мозга.
У 32 больных группы риска, наоборот, церебральные пароксизмы донозологического периода развертывались на фоне ЭЭГ признаков повышения пароксизмальной готовности мозга и в условиях отсутствия постоянной патологической активности указывающей на прямое органическое повреждение неспецифических систем мозга. Однако и у этих больных по данным ЭГГ исследования можно было говорить о дисфункции структур ЛРК.
Таблица 11. Электроэнцефалографическая характеристика больных группы риска по эпилепсии
|
пп |
Характер ЭЭГ изменений | Количество больных | % |
| 1 | Сочетание постоянной и пароксизмальной патологической ЭЭГ активности | 120 | 52,8 |
| 2 | Только пароксизмальная патологическая ЭЭГ активность | 32 | 14,0 |
| 3 | Только постоянная патологическая ЭЭГ активность | 38 | 17,0 |
| 4 | Вариант возрастной ЭЭГ нормы | 37 | 16,2 |
| 5 | Общее количество больных групп риска | 222 | 100 |
У 120 больных, что составило 52,8% наблюдений группы риска, церебральные пароксизмы донозологического периода эпилепсии развертывались в условиях ЭЭГ признаков органического повреждения и дисфункции срединных структур мозга. Основанием для подобного суждения явилось сочетание у этих больных постоянной патологической, преимущественно медленной ЭЭГ активности и патологической пароксизмальной активности.
В целом, результаты ЭЭГ исследования больных находящихся в донозологическом периоде эпилепсии указывали на органическое повреждение и нарушение функционального состояния структур лимбической коры, диэнцефалона и неспецифических систем ствола мозга. ЭЭГ феноменами, указывающими на органическое повреждение этих структур, считали преимущественно постоянную патологическую ЭЭГ активность и признаки запаздывания церебрального электрогенеза, выявленные у 70% больных группы риска. Они расценивались нами в качестве неспецифичных для собственно эпилепсии в любом периоде развития заболевания, являлись ЭЭГ выражением органического повреждения мозга, перенесенного в периоде беременности, родов, либо в постнатальной жизни ребенка и указывали на топический диагноз заболевания. На изменение функционального состояния
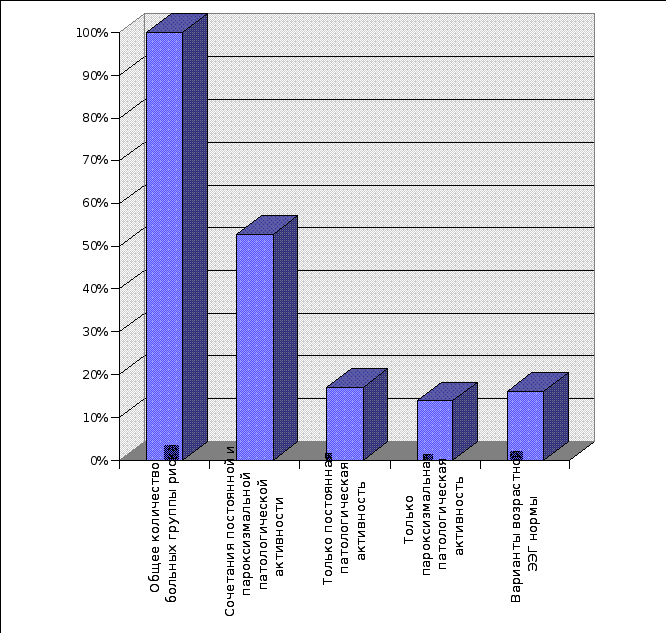
227 больных (100% наблюдений)
структур ЛРК указывала пароксизмальная патологическая ЭЭГ активность, выявленная у 67% больных.
Особое значение в патофизиологии донозологического периода эпилепсии придавали ЭЭГ феноменам пароксизмальной условно-эпилептической активности, которая встречается и у больных развернутыми клиническими вариантами эпилепсии, и более того, нередко является основным ЭЭГ коррелятом заболевания. Пароксизмальная условно-эпилептическая активность на ЭЭГ зарегистрирована у 58% больных группы риска. Это позволило заключить, что именно она в значительной меpe отражала патофизиологическую сущность донозологического периода эпилепсии в наших наблюдениях. Графоэлементы типичной эпилептической активности, зарегистрированные у 9% больных группы риска, указывали на более глубокие патологические изменения церебральной нейродинамики. Они наглядно подтверждали патофизиологическую общность донозологической и манифестной стадий эпилепсии в рамках единого эпилептического процесса и отражали его развитие.
3.2. Анализ результатов комплексного исследования больных группы риска по эпилепсии.
В настоящем разделе производится анализ основных характеристик заболевания у больных группы риска, а именно этиологии, патогенеза, клинической картины и топического диагноза, иначе говоря всего того, что можно было бы назвать неврологией донозологического периода эпилепсии.
Определение церебрального пароксизма, данное комитетом экспертов ВОЗ и приведенное в первой главе издания является универсальным и касается, как эпилептических, так и неэпилептических пароксизмов. Оно содержит также общие указания на патогенез, клинические проявления и топический диагноз. В частности, патогенез пароксизма состоит во «временной дисфункции всего мозга или каких-либо его отделов». И действительно, убедительным доказательством дисфункции всего мозга во время пароксизма, может служить, например, утрата сознания. Что же касается других «каких-либо отделов мозга», то прежде всего мы обратили внимание на структуры лимбико-ретикулярного комплекса (ЛРК), вовлечение которых в реализацию церебральных пароксизмов можно предположить исходя из того же определения пароксизма, включающего наличие «разнообразных моторных, сенсорных, вегетативных и психических феноменов» в клинической картине приступа. Результаты ЭЭГ исследования, изложенные в предыдущем разделе, определенно указывали на участие структур ЛРК в качестве топического диагноза эпилептических и неэпилептических пароксизмов донозологического периода эпилепсии. Оставалось подтвердить это предположение и другими методами исследования. Как известно, достаточно изученными функциями ЛРК являются: регуляция уровня бодрствования и качества сна, модально неспецифической памяти, вегетативной функции, эмоционального поведения, инстинктов и мотиваций, автоматическая интеграция психической, соматической и вегетативной сторон поведенческого акта, регуляция самых разнообразных форм непроизвольной, поведенческой деятельности, адаптирующей человека к изменяющимся условиям среды [Вейн А.М., 1991; Passouant P., 1974 и др.]. Очевидно, что наличие симптомов нарушения этих функций в клинической картине пароксизма, в межприступном состоянии, а также в преморбидном периоде, предшествовавшем развертыванию первых пароксизмов, указывало бы на заинтересованность в процессе глубинных структур мозга.
В таблице 12 представлены результаты исследования основных этиологических факторов заболевания больных группы риска по эпилепсии. По данным расспроса родителей и анализа истории развития ребенка оказалось, что все больные были рождены в условиях действия разнообразных сочетаний факторов риска по пре- и перинатальной органической патологии мозга. Наиболее частыми факторами риска являлись токсикозы первой и второй половины беременности, составившие 64% наблюдений, угроза прерывания беременности - 44%, и недоношенность различной степени - 37%. Последующие по частоте позиции занимали различные хронические заболевания внутренних органов матери, преимущественно сердечно-сосудистой и мочеполовой системы – 28%, аномалии родового акта, ручные, инструментальные акушерские пособия и родоразрешение хирургическим путем - 22%, асфиксия в родах - 18% и профессиональные и бытовые интоксикации - 9% наблюдений.
У 56% больных в неонатальном периоде диагностированы клинические варианты перинатальной энцефалопатии, которая встречалась у больных с единичными эпилептическими припадками значительно чаще, чем у больных с повторными неэпилептическими пароксизмами. Следует отметить, что у большинства больных это была энцефалопатия легкой степени, протекающая в следующих клинических вариантах: синдрома повышенной нейрорефлекторной возбудимости - 21%, синдрома двигательной дисфункции - 16%, синдрома вегетативно-висцеральной дисфункции - 7%, гидроцефального синдрома - 4% и судорожного синдрома - 3% больных. Кроме того, у 5% больных клинический вариант перинатальной энцефалопатии не был идентифицирован, но лишь заподозрен в связи с общим состоянием новорожденного, оцененного в 8 баллов по шкале Ангар. Органические заболевания мозга другой этиологии
Таблица 12. Основные этиологические факторы заболевания у больных группы риска по эпилепсии.
|
|
Этиологические | Больные группы риска | |||||
| пп | факторы | эпилептические припадки | неэпилептические пароксизмы | всего | |||
| кол-во больных | % | кол-во больных | % | кол-во больных | % | ||
| 1 | Факторы риска по пре- и перинатальной органической патологии мозга в различных сочетаниях | 161 | 100 | 66 | 100 | 227 | 100 |
| 2 | Клинические варианты перинатальной энцефалопатии | 108 | 67 | 20 | 30 | 128 | 56 |
| 3 | Черепно-мозговая травма, энцефалиты, менингиты, менингоэнцефа-литы в постнатальном периоде | 26 | 16 | 8 | 12 | 34 | 15 |
| 4 | Наследственный анамнез осложненный по эпилепсии | 21 | 13 | 5 | 8 | 26 | 11,5 |
| 5 | Наследственный анамнез осложненный по другим пароксизмам | 31 | 19 | 11 | 17 | 42 | 18,5 |
| 6 | Общее количество больных группы риска | 161 | 100 | 66 | 100 | 227 | 100 |
имели в наших наблюдениях весьма скромное значение и выявлены лишь у 15% больных: закрытая черепно-мозговая травма - у 9% и инфекционные заболевания мозга - у 6% больных.
Наследственный анамнез оказался осложненным по ЦП у 30% больных. Из них у 11,5% это была эпилепсия у кровных родственников больного и у 18,5% другие церебральные пароксизмы, среди которых доминировали пароксизмальные нарушения сна (7%), фебрильные и аффективно-респираторные припадки (7%). У остальных 4,5% больных это были другие неэпилептические пароксизмы.
В связи с неослабевающим вниманием исследователей к роли наследственного фактора в происхождении эпилепсии, нам также представляется возможным изложить несколько определенных суждений. Во-первых, в донозологическом периоде эпилепсии, наследственность, осложненная по эпилепсии и неэпилептическим ЦП распределилась примерно одинаково среди больных перенесших как единичные эпилептические припадки, так и повторные неэпилептические пароксизмы. Этот факт указывает на определенную степень общности происхождения эпилептических и неэпилептических пароксизмов у детей. Во-вторых, у больных группы риска по эпилепсии наследственный фактор не являлся изолированной причиной ЦП ни в одном наблюдении и непременно сочетался с перенесенными ранее органическими повреждениями мозга. Последние же будучи выявленными в анамнезе у всех больных группы риска по эпилепсии, являлись единственным этиологическим фактором в 70% наблюдений. Следовательно, можно предположить, что у наших больных наследственный фактор не имел прямого этиологического значения, но проявил себя предпочтительнее как патогенетический или патофизиологический фактор донозологического периода эпилепсии у детей.
Ретроспективный анализ состояния здоровья больных группы риска по эпилепсии в преморбидном периоде позволил выявить у многих больных определенную клиническую патологию, указывавшую на дисфункцию структур ЛРК, которую мы связывали с органическими повреждениями мозга, полученным главным образом в период беременности и родов (таблица 13). Так, например, по поводу неврозов, невропатии и неврозоподобных синдромов наблюдались 27% больных, различных клинических вариантов вегетативной дистонии - 25%, аномалий поведения в виде гипервозбудимости, гиперактивности и психомоторной расторможенности - 9%, внутренней гидроцефалии боковых и третьего желудочков и адипозного статуса - по 7% и по поводу нарушений терморегуляции - 3% больных. В целом оказалось что 78% больных группы риска до развертывания первых церебральных пароксизмов уже имели те или иные неврологические проявления со стороны неспецифических систем мозга. Кроме того, 12% из этих больных оказались часто болеющими простудными и общесоматическими инфекционными заболеваниями, что также, по нашему мнению, косвенно указывало на снижение резервов адаптации и возможность иммунодефицита, связанных с нарушением функции ЛРК.
Следует отметить, что названная выше патология, как правило не имела тяжелой клинической выраженности и находилась на втором плане у больных, основной жалобой которых были ЦП. Она обнаруживалась при дополни тельном расспросе, а также посредством анализа медицинских документов и в целом носила компенсированный, а порою и субклинический характер. Для настоящего исследования это легкая клиническая патология была интересна прежде всего своим топическим диагнозом, поскольку указывала на существование определенной предиспозиции глубинных структур мозга к реализации развертывающихся в последующем церебральных пароксизмов В соответствии с задачами настоящего раздела издания произведен анализ основных клинических проявлений донозологических церебральных пароксизмов (таблица. 14). При этом выделили четыре основные группы синдромов, которые по своей частоте занимали следующие позиции: нарушение сознания - у 93% больных, симптомы вегетативной дисфункции - у 89%, генерализованные судороги - у 74% и нарушения сна - у 27,5% больных. Нарушение сознания во время приступа отмечались в большинстве наблюдений за исключением немногочисленных больных с парциальными и
Таблица 13. Клиническая патология структур ЛРК в преморбидном периоде у больных группы риска по эпилепсии.
|
|
Вид | Больные группы риска | |||||
| пп | клинической | эпилептические припадки | неэпилептические пароксизмы | всего | |||
| патологии | кол-во больных | % | кол-во больных | % | кол-во больных | % | |
| 1 | Всего больных группы риска | 161 | 100 | 66 | 100 | 227 | 100 |
| 2 | Неврозы, невропатии, неврозоподобные синдромы | 43 | 27 | 18 | 27,5 | 61 | 27 |
| 3 | Вегетативная дистония | 42 | 26 | 15 | 22,5 | 57 | 25 |
| 4 | Аномалии поведения | 12 | 7,5 | 8 | 12,5 | 20 | 9 |
| 5 | Внутренняя гидроцефалия боковых и третьего желудочков мозга | 10 | 6,5 | 6 | 9 | 16 | 7 |
| 6 | Адипозный статус | 11 | 7 | 5 | 7,5 | 16 | 7 |
| 7 | Нарушение терморегуляции | 5 | 3 | 2 | 3 | 7 | 3 |
| 8 | Общее кол-во больных | 123 | 77 | 54 | 82 | 177 | 78 |
Таблица 14. Основные клинические проявления пароксизмального синдрома у больных группы риска по эпилепсии
|
|
Клинические | Больные группы риска | |||||
| пп | проявления | эпилептические припадки | неэпилептические пароксизмы | всего | |||
| пароксизмов | кол-во больных | % | кол-во больных | % | кол-во больных | % | |
| 1 | Всего больных группы риска | 161 | 100 | 66 | 100 | 227 | 100 |
| 2 | Генерализован-ные судороги | 144 | 90 | 24 | 36 | 168 | 74 |
| 3 | Нарушение сознания | 149 | 92 | 63 | 95 | 212 | 93 |
| 4 | Вегетативная дисфункция | 144 | 90 | 48 | 73 | 192 | 89 |
| 5 | Нарушения сна | 32 | 20 | 29 | 44 | 61 | 27,5 |
гемиконвульсивными эпилептическими припадками и вегетативными неэпилептическими пароксизмами. Вегетативные нарушения считали отсутствующими в структуре приступа лишь у больных со снохождениями и ночными вздрагиваниями, а генерализованные судороги - у больных с парциальными эпилептическими припадками, вегетативными и гипническми пароксизмами. В качестве нарушений сна расценивались ночные эпилептические припадки и собственно неэпилептические парасомнии. Кроме того, у больных ночными страхами и снохождениями клиническую основу пароксизмов составляли нарушения целостных форм поведения, не учтенные данными таблицы.
Избранные для анализа синдромы, составлявшие клинику пароксизмов у большинства больных, носили универсальный характер, являлись общими для эпилептических и неэпилептических пароксизмов и были сравнимыми по частоте как у больных первыми эпилептическими припадками, так и неэпилептическими повторными пароксизмами. Они свидетельствовали о грубом нарушении функций неспецифических систем мозга и указывали, таким образом, на топический диагноз церебральных пароксизмов в донозологическом периоде эпилепсии.
Результаты комплексного исследования больных группы риска по эпилепсии, произведенные в межприступном периоде оказались следующими. По данным объективного неврологического исследования в стационаре, немногочисленные очаговые неврологические симптомы, легко выраженные и имеющие двухсторонний рассеянный характер были обнаружены у 93% больных, а у остальных 7% – симптоматика «укладывалась» в неврологические синдромы - парезы конечностей, нарушения мышечного тонуса, равновесия, функций черепных нервов и др.
У 60% больных выявлены неспецифичные для эпилепсии поведенческие и личностные нарушения невротического типа, характер которых изложен в предыдущей главе. Они состояли в повышенной утомляемости больных при физической работе и умственной деятельности, нарушении эмоционального равновесия, снижении модально неспецифической памяти, психомоторной расторможенности, трудной управляемости поведением детей в детских учреждениях, школе и дома и др. Еще у 12% больных можно было говорить о нарушениях психики эпилептического типа, проявлявшихся соответствующими эмоционально-волевыми, интелектуально-мнестическими и личностными нарушениями. Однако и эти синдромы нарушения психики были представлены мягко и не вызывали существенной дезадаптации больных. Тем не менее они подтверждали преемственность нарушений психики в процессе развития заболевания и тем самым его динамику от донозологических до типичных проявлений.
Обзорная краниография в двух проекциях позволила выявить рентгенологические признаки умеренно выраженной внутричерепной гипертензии хронического типа у 29% больных: пальцевые вдавления распространяющиеся из теменно-затылочной области в средние и передние отделы мозгового черепа, незначительно выраженное истончение костей свода черепа, порозность структур турецкого седла, расширение вен губчатого вещества костей свода черепа и др. Эхоэнцефалоскопическое исследование показало, что у 32% больных имелись патологические признаки свидетельствующие об изменении контуров боковых, расширении третьего желудочка мозга и повышении внутричерепного давления.
Результаты ЭЭГ исследования подвергнуты анализу в предыдущем разделе настоящей главы. Здесь же необходимо привести лишь основные информационные данные. Так, например, патологические изменения на ЭЭГ обнаружены у 84% больных группы риска. Они включали в себя 3 разновидности патологической ЭЭГ активности, а именно: пароксизмальную активность, постоянную патологическую активность и ЭЭГ признаки запаздывания созревания церебрального электрогенеза. В целом, патологические изменения на ЭЭГ расценивались как следствие органического повреждения глубинных структур мозга и их функциональной несостоятельности.
Следует отметить, что в отечественной литературе последних лет некоторыми авторами приводятся результаты клинического исследования и анализ прогностического значения отдельных разновидностей церебральных пароксизмов преимущественно неэпилептического характера: аффективно-респираторных и фебрильных припадков, обмороков, гипнических, вегетативных и других пароксизмов. Эти сведения были изложены в первой главе издания. Что касается выделения донозологического периода эпилепсии в целом как закономерного и облигатного этапа заболевания, с пароксизмальными проявлениями как эпилептического, так и неэпилептического типа, то подобных исследований мы не обнаружили ни в отечественной, ни в зарубежной литературе. И в настоящей работе произведена лишь первая попытка подобного комплексного исследования, в котором патофизиологические и прогностические проблемы донозологического периода эпилепсии скорее были только поставлены, чем полностью разрешены.
Подводя итоги предпринятого патофизиологического исследования, можно сказать, что его результаты оказались в значительной мере созвучными с традиционными сообщениями исследователей о том, что в манифестном периоде эпилепсии грубые очаговые повреждения специфических или классических систем мозга не являются характерными. Результаты настоящего исследования позволяют объяснить эти факты тем, что в топическом диагнозе как развернутых форм эпилепсии, так и ее донозологических проявлений основное значение следует придавать неспецифическим системам мозга, органическое повреждение которых и связанные с этим нарушения функционального состояния занимают существенное место в патофизиологии эпилепсии на любой стадии заболевания, начиная с первых церебральных пароксизмов. Клинические доказательства правомочности такого заключения в нашем исследовании получены трижды: в периоде жизни ребенка, предшествовавшем развертыванию первых церебральных пароксизмов, в межприступном состоянии и посредством анализа клинических проявлений собственно пароксизмов. При этом корреляция клинических данных с результатами дополнительных методов исследования оказалась достаточно высокой.
По нашим данным в основе патофизиологии эпилептических и неэпилептических пароксизмов донозологического периода эпилепсии у детей лежали нарушения функционального состояния глубинных структур мозга (неспецифических систем, срединных структур, образований ЛРК). Важным проявлением этой дисфункции являлась повышенная пароксизмальная готовность мозга, основным ЭЭГ коррелятом которой в нашем исследовании выступили пароксизмальные формы биоэлектрической активности мозга. У 58% больных это была условно-эпилептическая активность. Эти данные свидетельствовали о том, что ЭЭГ корреляты донозологического и манифестного периодов эпилепсии являются принципиально одинаковыми. Различие состоит в том, что при развернутых клинических формах эпилепсии на ЭГГ значительно чаще доминирует типичная эпилептическая активность, что можно объяснить более «зрелым» состоянием заболевания, приобретшего черты нозологической формы.
Полученные результаты исследования приобретают существенное значение еще и в связи с тем, что они представляют собой доказательства определенной степени общности неврологии всех церебральных пароксизмов - этиологии, патофизиологии, клинической картины и топического диагноза. Таким образом, впервые получены доказательства отвергающие случайный характер, и наоборот, объясняющие определенную закономерность появления в донозологическом периоде эпилепсии не только логично ожидаемых в нем эпилептических припадков, но и атипично протекающих неэпилептических пароксизмов, развертывающихся в условиях действия значимых факторов риска по эпилепсии.
Важное значение полученных результатов исследования состоит также и в том, что они указывают на органическую природу дисфункции структур ЛРК, а также и на основной этиологический фактор этой дисфункции - органическое повреждение мозга, полученное главным образом, в периоде беременности и родов.
И наконец, результаты исследования показали, что органическое повреждение структур ЛРК у наших больных не имело грубого анатомического характера, поскольку не представляло угрозы для жизни, не вызывало тяжелых устойчивых состояний клинической декомпенсации или существенной возрастной дезадаптации заболевших. В целом, клиническое состояние больных и результаты дополнительных методов исследования свидетельствовали о том, что морфологические структуры лимбической коры, диэнцефалона и ретикулярной формации ствола мозга были в значительной мере сохранными и обеспечивали физиологический уровень регуляции основных, присущих им функций в межприступном состоянии. Наиболее же выраженная декомпенсация этих функций наступала в процессе развертывания пароксизмов и носила, таким образом, временный, преходящий характер.
ГЛАВА 4. МЕДИЦИНСКАЯ ТАКТИКА ПРИ ЦЕРЕБРАЛЬНЫХ ПАРОКСИЗМАХ У ДЕТЕЙ И ЛЕЧЕНИЕ ЭПИЛЕПСИИ В ДОНОЗОЛОГИЧЕСКОМ ПЕРИОДЕ ЗАБОЛЕВАНИЯ
4.1. Основные положения рациональной медицинской тактики при первых церебральных пароксизмах у детей
Исходя из современных представлений о природе церебральных пароксизмов, принципа стадийности в формировании и течении эпилептического процесса с наличием донозологического периода заболевания и выделенных вариантов его клинических проявлений, разработанная нами и рекомендуемая для практического применения медицинская тактика при первых церебральных пароксизмах у детей представляет собой определенную последовательность врачебных действий.
Идентификация церебрального характера пароксизма и определение его эпилептической или неэпилептической природы;
Размещение заболевания в одном из возможных четырех клинических вариантов донозологического периода эпилепсии;
Поиск факторов риска по эпилепсии в каждом наблюдении и осуществление прогнозирования течения заболевания;
Формирование группы риска по эпилепсии, состоящей из больных являющихся носителями опасных сочетаний значимых факторов риска;
Назначение комплексного превентивного антиэпилептического лечения больным группы риска с включением постоянного приема профилактических доз АЭП не менее чем на 2 года; комплексное лечение больных не угрожаемых по формированию эпилепсии без включения АЭП;
Диспансерное наблюдение всех детей с церебральными пароксизмами.
Первый этап медицинской тактики является традиционным для практической деятельности врача. Он состоит в идентификации церебрального характера пароксизма и определении его эпилептической или неэпилептической природы. Решение этого вопроса всегда было непростым делом. И действительно, в процессе дифференциальной диагностики первого пароксизма врач должен проявить весьма высокий уровень профессионализма уже потому, что ему необходимо удерживать в памяти клинические проявления нескольких десятков клинических разновидностей эпилептических припадков и неэпилептических пароксизмов, с тем, чтобы сравнивая их, прийти к определенному выводу. При этом традиционные дифференциально-диагностические трудности акцентируются тем обстоятельством, что пароксизмы являются первыми или немногочисленными. Поэтому широко известные их признаки, выделенные у больных находящихся в развернутой стадии заболевания не всегда могут быть использованы. Речь идет, например, о таких типичных признаках эпилептических припадков у больных эпилепсией, как цикличность, стереотипность клиники, спонтанность и повторность.
Производится тщательный анализ клинических проявлений пароксизма и обстоятельств его развертывания, при этом непременно учитываются: возраст больного, возможные провоцирующие факторы, время суток, род занятий, поза, положение тела и общее состояние больного непосредственно перед началом пароксизма. Изучается анамнез заболевания, жизни, наследственный анамнез, результаты объективного соматического, неврологического и дополнительных методов исследования. В случаях непреодолимых затруднений в идентификации эпилептического или неэпилептического характера пароксизма, мы удовлетворялись выявлением признаков указывающих на его церебральную природу, на основании соответствующих критериев, содержащихся в определении церебрального пароксизма, разработанного комитетом экспертов ВОЗ, и приведенного в первой главе.
В данной ситуации мы не переоценивали и результаты ЭЭГ исследования, помня о том, что они не могут заменить собой квалифицированную обработку клинического материала или надежно идентифицировать характер пароксизма. Данные литературы и собственный опыт не позволяют сделать вывод о большой ценности ЭЭГ исследования при первых ЦП у детей. Кроме того, при первых безусловно эпилептических пароксизмах, патологические ЭЭГ изменения не должны приобретать прямого диагностического значения. Их следует истолковывать лишь как фактор риска по эпилепсии в связи с тем, что в донозологическом периоде еще отсутствует основной клинический критерий заболевания, определяющий диагноз эпилепсии, а именно повторные спонтанные ЭП.
На втором этапе медицинской тактики идентифицированный ЦП относили к одному из четырех возможных клинических вариантов ДПЭ. Причем, если первый пароксизм расценивался в качестве эпилептического припадка, то его относили либо к спонтанным припадкам, либо считали проявлением эпилептической реакции или эпилептического синдрома в соответствии с критериями изложенными выше. При неэпилептическом характере пароксизмов, последние занимали свое место в соответствующем перечне, содержащемся в первой и второй главах. При этом, во всех случаях где это было возможно, в диагнозе заболевания учитывался основной патологический процесс, проявлением которого являлись церебральные пароксизмы. В качестве примеров формулирования диагноза на втором этапе медицинской тактики могут быть следующие: «Перинатальная энцефалопатия гипоксически-травматического генеза. Ранний восстановительный период. Эпилептический синдром. Первый эпилептический генерализованный судорожный тонико-клонический припадок». Или: «Острая респираторная вирусная инфекция. Первый фебрильный генерализованный судорожный припадок». Если у больного не могли быть выявленными ни предполагаемая этиология, ни непосредственные провоцирующие припадок факторы, то это также находило соответствующее отражение в диагнозе, например: «Первый спонтанный эпилептический припадок grand mal невыясненной этиологии».
Примеры формулирования диагноза заболевания с неэпилептическими пароксизмами в клинической картине: «Вегетативная дистония травматической этиологии. Нейрогенный обморок»; или «Невроз. Пароксизмальные нарушения сна. Ночные страхи»; или: «Рахит. Тетания. Карпопедальные спазмы» и др.
Пример формулирования диагноза заболевания с не идентифицированным эпилептическим или неэпилептическим характером пароксизма: «Резидуальные явления перинатальной энцефалопатии. Первый ночной церебральный пароксизм бессудорожной семиологии» и др.
На третьем этапе медицинской тактики осуществлялось прогнозирование эпилепсии в каждом наблюдении. Основным содержанием процесса прогнозирования являлся поиск значимых факторов риска с учетом специфических особенностей основных разновидностей ЦП и индивидуальных клинических проявлений заболевания.
При эпилептическом характере первых пароксизмов искомыми факторами риска по эпилепсии высокой значимости являлись следующие: сам факт однократного развертывания пароксизма, наследственный анамнез, осложненный по эпилепсии, обнаружение пароксизмальной активности на ЭЭГ, текущее органическое заболевание мозга, либо перенесенное ранее и выявленное на основании результатов комплексного объективного обследования, клиническая тяжесть пароксизма и послеприступного состояния. Под клинической тяжестью понимали судорожный характер, большую продолжительность и серийность пароксизмов, глубокое расстройство сознания и замедленный темп его восстановления, нарушение поведения в послеприступном периоде или очаговый неврологический дефицит. Кроме того, у больных фебрильными припадками производился поиск еще двух дополнительных факторов риска высокой значимости, выявленных на материале первой группы наблюдений у больных эпилепсией с фебрильными припадками в анамнезе. Первый из них выявлялся уже при однократном припадке и состоял в фебрильных значениях температуры тела, провоцирующей первый припадок, и, следовательно, в отсутствии гипертермии. Сюда же отнесли единичные наблюдения с генерализованными судорожными припадками, вызванными перегревом ребенка неинфекционного происхождения - продолжительным пребыванием на солнце, в горячей ванне, в бане. Второй фактор риска этой группы обнаруживался у больных с повторными фебрильными припадками и состоял в прогрессирующем снижении температуры тела, провоцирующей очередные фебрильные припадки. Например, первый фебрильный припадок развертывался на температуру тела 40,0°С, второй - на 39,0°С, третий - на 38,0°С или на упомянутый выше перегрев неинфекционного происхождения. У таких больных четко прослеживалась тенденция, состоящая в угрозе появления афебрильного (неспровоцированного) припадка в качестве очередного приступного эпизода, что и имело место в действительности у ряда больных эпилепсией с фебрильными припадками в анамнезе.
У больных эпилептическим синдромом прогнозирование эпилепсии осуществляется в два этапа. В остром периоде органического заболевания мозга, например при энцефалите, диагностированном варианте перинатальной энцефалопатии острого периода, протекающей с судорожным синдромом, в группу риска по эпилепсии помещали всех больных, учитывая характер основного патологического процесса. В дальнейшем, медицинская тактика у них зависела и от других факторов - непосредственного исхода основного заболевания, динамики неврологического статуса и рецидива пароксизмов, о чем дополнительно сообщается ниже.
В целом, прогнозирование эпилепсии у детей с первыми эпилептическими припадками нам представляется вполне обычным делом. Но если ранее, этот процесс осуществлялся эпизодически, не всеми врачами и на фоне не редких тактических ошибок, то в настоящем исследовании ему придается облигатный характер и научное обоснование в виде выделения донозологического периода заболевания, по окончании которого эпилепсией заболевают не все дети, перенесшие единичные эпилептические припадки, а лишь носители значимых факторов риска по эпилепсии, которые проявляют свое действие в условиях отсутствия квалифицированной врачебной помощи.
Что касается прогнозирования эпилепсии у детей с неэпилептическими ЦП, то сам этот факт имеет определенную новизну, связанную с преодолением традиционных ошибочных представлений о полном отграничении их от эпилептических припадков во всех клинических ситуациях и у всех больных. На практике это нередко приводит к полному игнорированию патологического значения неэпилептических пароксизмов в качестве факторов риска по эпилепсии, отказу от превентивного лечения заболевания у одной трети больных эпилепсией и предоставление донозологическому периоду этого заболевания возможности спонтанного течения.
Между тем, по данным литературы и личного опыта мы убедились в том, что практически трудно назвать известные церебральные пароксизмы, которые не могли бы оказаться в анамнезе больных эпилепсией. Некоторые авторы уже применяют превентивное назначение постоянного приема АЭП при отдельных разновидностях пароксизмов, приобретающих в своей динамике пограничные с эпилептическими припадками клинические черты - аффективно-респираторных, обморочных, фебрильных, метаболических пароксизмах. Известен положительный эффект применения АЭП при мигрени, других пароксизмальных цефалгиях, лицевых болях, вегетативных пароксизмах и даже при синдроме Меньера. Наша задача состояла в том, чтобы систематизировать отдельные научные факты и накопленный опыт и распространить его на повседневную клиническую практику. Принципиальные особенности течения неэпилептических пароксизмов в донозологическом периоде эпилепсии изложенных выше. Здесь же необходимо назвать два новых фактора риска по эпилепсии, выделенных нами у подобных больных: повторное развертывание пароксизмов и атипизм их клиники и обстоятельств развертывания.
Таким образом, определились две существенные особенности прогнозирования эпилепсии связанные с характером донозологических ЦП. Первая состояла в том, что у больных с эпилептическим характером первого ЦП прогнозирование эпилепсии и формирование группы риска начинали медленно. Необходимым же фактором риска у больных неэпилептическими ЦП являлось их повторное развертывание, в процессе анализа которого в некоторых наблюдениях выявлялся и другой фактор риска высокой значимости, а именно атипизм клинических проявлений и обстоятельств развертывания приступов.
Содержанием четвертого этапа медицинской тактики является формирование группы риска по эпилепсии, состоящей из больных с единичными ЭП и повторными, атипично протекающими неэпилептическими ЦП. Критерием отбора ребенка в группу риска было наличие у него 2-х и более факторов риска высокой значимости (см. схему прогнозирования эпилепсии во второй главе). Именно такое их сочетание обнаружено в донозологическом периоде у каждого ребенка заболевшего эпилепсией. В предыдущих главах представлены клиническая структура, количественный состав и удельный вес ЦП у детей составивших группу высокого риска по эпилепсии в наших наблюдениях и представлен анализ результатов комплексного исследования ДПЭ у детей.
Принципы формулирования диагноза на данном этапе врачебной тактики оставались теми же, что и при первичной идентификации ЦП. Для обозначения же принадлежности заболевания к группе риска по эпилепсии и обоснования превентивной антиэпилептической терапии, в диагноз вносили соответствующие дополнения, например: «Перинатальная гипоксическая энцефалопатия. Поздний восстановительный период. Аффективно-респираторные припадки с факторами риска по формированию эпилепсии» и др.
4.2. Лечение донозологических проявлений эпилепсии и методика диспансерного наблюдения при церебральных пароксизмах у детей
Содержанием пятого этапа медицинской тактики является дифференцированное лечение детей с ЦП. В связи с тем, что больные группы риска расцениваются как пребывающие в ДПЭ, всем им проводится комплексное лечение, предусматриваемое обычно и для манифестных форм заболевания. Имеется в виду дегидратационная и рассасывающая терапия, оксигенация и коррекция метаболизма мозга, общеукрепляющее лечение и др., которое осуществлялось в плановом порядке, чаще всего амбулаторно, по курсовой методике, с продолжительностью курса 1 месяц и кратностью 1-2 раза в год на протяжении не менее 2-х лет, которые составили в наших наблюдениях среднюю продолжительность донозологического периода эпилепсии. Обоснованием такого фонового лечения являлись результаты собственных исследований, свидетельствующие о том, что основным этиологическим фактором клинических проявлений донозологического периода заболевания являются органические повреждения мозга, идентичные таковым при эпилепсии.
В качестве дегидратации назначали диакарб, лазикс, фурасемид, и другие препараты в возрастных дозах преимущественно перорально на фоне введения препаратов калия. Предпочтение отдавалось диакарбу, суточная доза которого вводилась однократно утром, трехдневными циклами с интервалом в 1 день на протяжении 1 месяца.
Рассасывающая терапия проводилась чаще всего парэнтеральным введением препаратов стекловидного тела, ФиБСа и др. в количестве 15-20 инъекций, с интервалом в 1-2 дня, за исключением больных обмороками и АРП, которым рекомендовали минимум инъекций в связи с их возможным провоцирующим приступ действием. Применяли также электрофорез с лидазой интраназально или по глазозатылочной методике.
Медикаментозная оксигенация мозга чаще всего осуществлялась препаратами никотиновой кислоты или ее производных типа никошпана, теоникола и др.
В качестве корректоров метаболизма мозга использовали кальция глюконат и глицерофосфат, глутаминовую кислоту, ноотропы, витамин B6 по 5-10 мг 2 раза в день внутрь и др.
Однако главным содержанием комплексного лечения больных группы риска являлась превентивная антиконвульсантная терапия в профилактических дозах, назначаемая в качестве непрерывного приема на протяжении не менее 2 лет. Больным с судорожным характером донозологических пароксизмов назначали фенобарбитал в суточной дозе 2-3 мг/кг (при неэпилептических ЦП – 2 мг/кг и при эпилептич6еских 3 мг/кг) или конвулекс – соответственно 10-15 мг/кг распределяемые в два приема. При определении профилактической дозы фенобарбитала, в условиях отсутствия в наших исследованиях лабораторного контроля за содержанием препарата в плазме, исходили из данных литературы, согласно которым пороговой величиной противосудорожного действия фенобарбитала является его концентрация в плазме, составляющая 15 мкг/мл. При этом искомой величиной, необходимой для достижения стабильности такой концентрации оказалась суточная доза фенобарбитала не менее чем 1,75 мг/кг [Eadie M.J., 1977, 1983]. В соответствии с приведенными данными, за оптимальную профилактическую дозу фенобарбитала у больных неэпилептическими судорожными пароксизмами приняли 2 мг/кг в сутки. При эпилептическом характере донозологических пароксизмов суточную дозу повышали до 3 мг/кг, и прежде всего это касалось больных эпилептическим синдромом. При бессудорожном характере пароксизмов предпочитали нитразепам, (радедорм, эуноктим, могадон, неозепам) от 0,1 до 0,З мг/кг в сутки. При гипнических донозологических пароксизмах этот препарат назначали всем больным, учитывая известные данные литературы о нормализации им электрофизиологической структуры сна в сторону увеличения представительства его быстрой фазы, препятствующей развертыванию эпилептических припадков.
Пятый этап медицинской тактики включает в себя и составление рекомендаций по полноценному лечению остальных больных с ЦП, составивших большинство во второй группе наших наблюдений. Они не являлись в данный момент времени носителями опасных сочетаний значимых факторов риска по эпилепсии и расценивались как не угрожаемые по развитию этого заболевания. Всем этим больным рекомендовалось лечение основного заболевания, возрастной режим дня и назначалась седативная терапия. В качестве седативных средств предпочитали препараты растительного происхождения - отвар и таблетки корня валерианы, отвар травы пустырника, а также некоторые препараты, которые относят к аддитивным средствам при лечении нозологической стадии эпилепсии - сиднокарб, феназепам, витамин B6 и др. Лечение этими медикаментами рекомендовали проводить курсами, продолжительностью 1 мес, которые чередовали на протяжении 2-х лет.
Из всех клинических разновидностей донозологических пароксизмов эпилептические припадки, диагностированные в рамках эпилептического синдрома являлись самыми опасными по угрозе формирования эпилепсии, в связи с наличием столь грозного фактора риска, каковым мы считали текущее органическое заболевание мозга. Поэтому, вопросы прогнозирования эпилепсии и назначения превентивной антиконвульсантной терапии решались у этих больных в два этапа. В остром периоде органического заболевания мозга, например, перинатальной энцефалопатии, энцефалита и др. медицинская тактика полностью соответствовала вышеизложенной только при наличии двух условий: однократного пароксизма и полной редукции очаговых неврологических симптомов в остром периоде заболевания. Если в этом периоде эпилептические припадки повторялись или развертывалась серия пароксизмов, а также в случаях персистирования очаговых неврологических симптомов, или рецидива припадков на выходе заболевания в восстановительный период, то применялся второй тактический прием, важным содержанием которого становилось продление антиконвульсивной терапии на период времени от 3 до 5 лет.
Заключительным этапом медицинской тактики является составление рекомендаций по диспансеризации детей с ЦП. Эти рекомендации включали в себя индивидуальное и комплексное лечение, настойчивую реабилитацию заболевших, раннюю диагностику эпилепсии, превентивное лечение, профилактику манифестных форм и прогрессирующего течения эпилепсии.
В процессе динамического наблюдения этих детей формируются три группы. В первую входят больные с церебральными пароксизмами без факторов риска по формированию эпилепсии, во вторую - больные, находящиеся в донозологическом периоде эпилепсии, и в третью группу – больные с диагностированной эпилепсией.
Большинство больных первой группы составляют дети с неэпилептическими пароксизмами и меньшую часть – перенесшие однократную эпилептическую реакцию или единственный спонтанный ЭП, а также дети с единичными ЦП, эпилептическая или неэпилептическая природа которых не определена. Все эти больные не обладают опасными сочетаниями значимых факторов риска по эпилепсии в количестве не менее двух, и в данный момент времени не являются угрожаемыми по развитию эпилепсии. Они наблюдаются с частотой не менее чем 1 раз в 6 месяцев, а при рецидивах эпилептических пароксизмов - по мере их развертывания. В случае ремиссии по пароксизмам продолжительность наблюдения не должна составлять менее 2-х лет, в течение которых плановое ЭЭГ исследование осуществляется ежегодно. При рецидивах пароксизмов ЭЭГ исследование проводится с частотой 1 раз в 6 месяцев. Всем больным этой группы осуществляется комплексное лечение основного заболевания, проводится седативная терапия, однако антиконвульсанты не назначаются. При ремиссии по пароксизмам и отсутствии неблагоприятной динамики на ЭЭГ в течение 2-х лет, больной подлежит снятию с диспансерного учета с исходом в выздоровление. При рецидивах пароксизмов в течение 2-х летнего периода возможно возникновение двух принципиальных ситуаций, связанных с характером пароксизмов и условиями их развертывания. Так, при рецидивах типичных неэпилептических пароксизмов больной остается в первой группе, а лечение и наблюдение ему автоматически продляется еще на 2 года. Вторая ситуация связана с возможным переводом больных первой группы во вторую, а именно: при рецидиве спонтанного эпилептического припадка больной переводится во вторую группу немедленно, а в случае рецидива фебрильных припадков и неэпилептических пароксизмов - лишь при появлении одного из факторов риска высокой значимости, таких как пароксизмальная активность на ЭЭГ и атипизм клинических проявлений и обстоятельств развертывания приступов.
Вторая группа состоит из больных, находящихся в донозологическом периоде эпилепсии. Это дети, перенесшие однократные или повторные эпилептические реакции, спонтанные эпилептические припадки, больные эпилептическим синдромом и некоторые больные с повторными неэпилептическими пароксизмами и с повторными ЦП, эпилептический или неэпилептический характер которых еще не определен окончательно. Диагноз эпилепсии этим больным не ставится, однако в связи с тем, что все они являются носителями опасных сочетаний значимых факторов риска по эпилепсии им проводится лечение основного заболевания и назначается постоянный превентивный прием антиконвульсантов по методике рассмотренной выше, на период времени не меньший чем 2 года после последнего пароксизма. Однако на практике, у конкретных больных, согласно общим принципам антиэпилептического лечения продолжительность превентивной терапии антиконвульсантами увеличивалась при воздействии дополнительных провоцирующих факторов в период ремиссии по припадкам. Например, при получении дополнительных органических повреждений мозга (черепно-мозговой травмы, энцефалита, менингита и др.) продолжительность превентивного лечения увеличивалась еще на 2 года, а при наступлении пубертатного периода - до его окончания.
Крайне важным является выполнение принципов продолжительности и непрерывности превентивного лечения. Исходя из этого, мы не можем поддержать методику назначения антиконвульсантов больным группы риска по эпилепсии короткими курсами - на период лихорадки, при ушибах головы и др. по нескольким причинам. Во-первых, некоторые антиконвульсанты, например, фенобарбитал, достигают стабильной терапевтической концентрации в плазме через 1,5-3 недели от начала его приема в средних суточных дозах. В этих условиях антиэпилептическое действие препарата не успевает проявиться во время лихорадки, которая заканчивается обычно значительно быстрее. Далее, та же методика предполагает и быстрое прекращение приема антиконвульсантов после окончания временного периода риска, что может, в свою очередь, спровоцировать припадок. И, наконец, известно, что вероятность как рецидива припадков, так и выздоровления больного эпилепсией, непосредственно связаны с продолжительностью ремиссии, то есть чем более продолжительной является ремиссия по припадкам, тем реже их рецидив и более возможным становится исход донозологического периода эпилепсии в выздоровление. В то же время замечено, что одной из самых частых причин рецидива припадков у больных эпилепсией является нарушение принципа непрерывности приема АЭП, порой даже в виде однократного пропуска приема препаратов.
Стойкость ремиссии по припадкам в донозологическом периоде эпилепсии, а следовательно и ее продолжительность, обеспечивается также и непрерывным поддержанием постоянного уровня концентрации препарата в плазме. Поэтому, весьма важным является своевременное увеличение абсолютной величины суточной дозы антиконвульсантов в связи с возрастом ребенка и увеличением массы его тела. Для этого в процессе диспансерного наблюдения необходимо взвешивать ребенка не реже чем 1 раз в 3 мес. и поддерживать запланированную дозу препарата из расчета на 1 кг массы тела. В целом эти больные наблюдаются с частотой 1 раз в 3 месяца и ЭЭГ исследование им проводится в плановом порядке каждые 6 мес. В случае ремиссии по припадкам в течение 2 лет и отсутствия отрицательной динамики на ЭЭГ, можно назначать постепенное снижение дозы антиконвульсанта с целью полной его отмены. Продолжительность этого процесса не должна составлять менее 6 мес., по истечению которых и при отсутствии рецидивов припадков больной снимается с учета.
Третья группа диспансерного наблюдения формируется из больных, находящихся в стадии манифестных проявлений эпилепсии. Основным критерием диагностики заболевания должно быть наличие у больного не менее двух неспровоцированных эпилептических припадков за период времени, максимальная продолжительность которых составляла не более 5 лет. Эти больные наблюдаются активно с частотой не реже 1 раз в 3 мес. и подвергаются ЭЭГ контролю дважды в год. Вопросы лечения, диспансеризации, течения болезни и критерии выздоровления детей больных эпилепсией подробно обсуждаются в соответствующей литературе, в том числе и в нашем руководстве для врачей [Миридонов В.Т., 1994]. И наконец, по мере наблюдения за больными необходимо предусмотреть возможную динамичность состава всех трех групп за счет выздоровления детей, естественного поступления новых больных и перемещения наблюдаемых из первой группы во вторую, из второй – в третью группу наблюдений.
В донозологическом периоде эпилепсии реабилитационные мероприятия являются неотъемлемой составной частью диспансерного наблюдения. Ограничение посещения детских учреждений и школы, не допускаются. Производится контроль возрастного режима дня и диеты. Рекомендуемая продолжительность сна, включая и дневное засыпание для детей младшего возраста составляет 12 часов, а для детей старшего возраста 10 часов. Основы диеты больных должна составлять белковая пища со значительным количеством молочных белков (творог, сыры и т.д.). Следует ограничивать прием жидкости, соленой пищи, копченостей и пряностей.
Всем больным показана лечебная физкультура и утренняя гимнастика. Вопрос о занятиях в спортивных секциях с участием в соревнованиях следует решать индивидуально. Противопоказаны водные, некоторые силовые виды спорта, например бокс, связанные с риском для жизни в случае развертывания припадка, либо дополнительно травмирующие больного.
Вопрос о профилактических прививках решается также индивидуально с учетом существующих официальных инструкций. Так, при неэпилептическом характере донозологических пароксизмов прививки осуществляются по возрастному графику, без каких-либо противопоказаний. При эпилептической реакции и первых спонтанных эпилептических припадках, вакцинацию весьма реактогенными вакцинами, как АКДС, вируса клещевого энцефалита и др., следует задержать на 6 месяцев. При судорожном варианте энцефалической реакции, судорогах при нейротоксикозе, профилактические прививки следует отсрочить на 6-12 месяцев, а при эпилептическом синдроме - до окончания позднего восстановительного периода основного заболевания. При проведении профилактических прививок рекомендуется шире использовать антигистаминные препараты за 7-10 дней до и в течение 2 недель после прививки.
Профилактика эпилепсии традиционно складывается из мероприятий первичного и вторичного, специфического и неспецифического характера. Первичная профилактика, к сожалению, не является специфической, хотя и имеет своей целью недопущение развертывания у ребенка не только эпилептических, но и неэпилептических пароксизмов. Поскольку, в наших наблюдениях, основным этиологическим фактором церебральных пароксизмов у детей являлись органические повреждения мозга, полученные в период беременности и родов, становится очевидным, что основу первичной профилактики эпилепсии составляет профилактика пре- перинатальной энцефалопатии. Однако, этого мало. Оказалось, что органический очаг у больных эпилепсией и неэпилептическими пароксизмами часто локализуется в неспецифических системах мозга, повреждение которых не всегда вписывается в рамки традиционных клинических вариантов перинатальной энцефалопатии. Более того, клинически оформленный вариант этого заболевания с наличием его острого периода отнюдь не является обязательным для получения, тем не менее, эпилептогенного повреждения мозга. В то же время установлено, что подавляющее большинство детей, больных эпилепсией, рождается в условиях действия факторов риска по органическому повреждению мозга в период беременности и родов. Следовательно, под первичной профилактикой эпилепсии нужно понимать широкий комплекс не только медицинских, но и социальных мероприятии, направленных на охрану здоровья матери и ребенка, находящихся в конкретной среде обитания, с целью ограничения или нейтрализации воздействия упомянутых факторов риска. Более реальной мерой первичной профилактики, при сохранении неспецифичности ее по отношению к эпилепсии, является раннее и настойчивое лечение всех клинических вариантов перинатальной энцефалопатии, постнатальных органических заболеваний мозга, общих инфекций и интоксикаций, полный учет противопоказаний к профилактическим прививкам.
Не следует возлагать существенных надежд на медико-генетическое консультирование, за исключением тех редких случаев, когда дается совет по ограничению рождаемости в семьях с заболеванием эпилепсией обоих родителей, либо с наследственностью, осложненной по эпилепсии по линии отца и матери.
Вторичная профилактика эпилепсии имеет специфическое содержание и начинается с появлением первых церебральных пароксизмов. Ее основу составляет превентивное лечение эпилепсии с включением постоянного приема антиконвульсантов больными группы риска. В нашей повседневной деятельности вопросы вторичной специфической профилактики тесно связаны с прогнозированием эпилепсии у детей и решаются одновременно по факту наличия первых ЦП. Мы не можем поддержать попытки и предложения, содержащиеся в современной литературе, проводить превентивную антиконвульсантную терапию детям, имеющим кровных родственников, болеющих эпилепсией, либо при выявлении пароксизмальной, пусть даже и эпилептической активности на ЭЭГ, или, наконец, при сочетании этих факторов у ребенка, не имевшего в своем личном анамнезе ни одного церебрального пароксизма.
Таким образом, основные особенности изложенной медицинской тактики при первых церебральных пароксизмах у детей состоят в дифференцированной их оценке, признании существования донозологического периода эпилепсии на основе современных представлений о природе церебральных пароксизмов, прогнозировании эпилепсии в каждом наблюдении с выделением опасных сочетаний значимых факторов риска по этому заболеванию, проведении превентивной антиэпилептической терапии с включением антиконвульсантов на постоянной основе больным группы риска и активном диспансерном наблюдении. Данная тактика легко осуществима в современных условиях практического здравоохранения, направлена на раннюю диагностику эпилепсии и реальную профилактику ее манифестных форм.
ЗАКЛЮЧЕНИЕ
Известный эпилептолог Гасто в своей статье под названием «Когда и как надо начинать лечить эпилепсию у детей», [Hastaut H., 1988] высказался определенно: лечить надо начинать тогда, когда поставлен диагноз эпилепсии. Главным содержанием ответа на вторую часть вопроса являлось многолетнее применение профильных для данного больного АЭП в индивидуально подобранных, порою в субтоксических дозировках. Однако по нашему мнению, для постановки столь тяжелого в клиническом и социальном отношении диагноза, каковым мы считаем эпилепсию, врачу необходимо иметь веские основания. Ведущим же критерием диагностики эпилепсии, согласно рекомендациям ВОЗ, являете наличие у больного повторных спонтанных (неспровоцированных) эпилептических припадков, допустимое количество которых, необходимое для постановки диагноза не определено, и лишь чисто теоретически не может быть менее, чем два припадка. В то же время, специальные исследования последних лет показали, что при спонтанном течении (без лечения) заболевания, промежуток времени от первого неспровоцированного эпилептического припадка, до его рецидива в среднем составляет от нескольких месяцев до нескольких лет, причем вероятность развертывания повторных припадков после единичного приступа не превышает 70% [Hart R.G., Faston J.D., 1988]. В то же время доказано, что рецидивы припадков становятся маловероятными при достижении ремиссии после первого эпилептического припадка продолжительностью 1-2 года [Besser R., Kramer G., 1983]. Изложенные факты явились основанием для трех важных суждений: во-первых - первый и единственный эпилептический неспровоцированный припадок не дает оснований диагностировать эпилепсию; во-вторых в течении заболевания непременно должны быть определенные условия, при наличии которых первый спонтанный эпилептический припадок обнаруживает склонность к рецидивированию и в-третьих - даже при наличии этих предрасполагающих условий, после первого спонтанного эпилептического припадка проходит весьма продолжительный период времени до его рецидива, чаще всего дающего основание поставить диагноз эпилепсии.
Помимо спонтанных эпилептических припадков в детском возрасте нередко встречаются и спровоцированные припадки единичного и повторного характера, диагностируемые в рамках эпилептического синдрома при различных текущих органических заболеваниях мозга, например, при таких как перинатальная энцефалопатия, черепно-мозговая травма, энцефалиты и др. а также так называемые случайные спровоцированные единичные припадки, известные в нашей стране под названием эпилептических реакций и выделенные последней международной классификацией эпилепсии 1989 r. в качестве специальных синдромов: фебрильные судороги, припадки при острых токсических состояниях и др. Согласно рекомендациям ВОЗ эти припадки также не являются еще эпилепсией, но определенная связь их с этим заболеванием несомненна и не отрицается в литературе. Более того, в настоящем издании приведены данные литературы и результаты собственного исследования прогностического значения относительно эпилепсии многих разновидностей неэпилептических пароксизмов. При этом констатировалось, что у детей, страдающих подобными пароксизмами, эпилепсия в последующем развивается чаще, чем в среднем в популяции и значительно чаще, чем у детей без каких-либо церебральных пароксизмов в личном анамнезе. Так например, П.М. Сараджишвили и Т.Ш Геладзе в известной монографии «Эпилепсия» отмечают: «... всем хорошо известно и то, что началу эпилептической болезни непосредственно, а иногда и задолго предшествуют, казалось бы безобидные спазмофильные или фебрильные припадки, ночные страхи, головные боли, абдоминальные, эпигастральные и другие вегетативные кризы, снохождения, ночной энурез, а также множество других пароксизмальных проявлений мозговой патологии» [Сараджишвили П.М., Геладзе Т.Ш., 1977].
Следует также отметить и появление в литературе таких терминов и понятий, как «фебрильная эпилепсия», «аффективно-провоцируемая эпилепсия», «обморокоподобная эпилепсия», «гипоталамическая эпилепсия», «эпилептические ночные страхи», «эпилептические снохождения», «эпилептоидная форма мигрени» и др. По нашему мнению эти термины появились не случайно и было бы ошибкой безусловно расценивать их как только профессиональные заблуждения отдельных авторов. Наоборот, они подчеркивают определенную степень общности неврологии неэпилептических и эпилептических пароксизмов, и как следствие этого - возможную преемственную связь между ними. Мы отдавали себе отчет в том, что применение этих терминов в качестве клинического диагноза составляет предмет для дискуссий, поскольку рано или поздно, у подавляющего большинства больных в развернутой стадии заболевания эпилепсия начинает проявляться типичными, как правило легко классифицируемыми эпилептическими припадками, однако не могли и игнорировать приведенные выше факты, особенно в контексте изучаемых донозологических проявлений эпилепсии. Выделение донозологического периода в качестве облигатного этапа формирования эпилепсии у детей являлось основной целью настоящего издания. Предстояло также изучить его основное клинические проявления, патофизиологию и продолжительность. Важная задача исследования состояла также и в том, чтобы не предоставлять заболевание своему спонтанному течению, но выработать адекватную медицинскую тактику при первых ЦП у детей, которая бы включала в себя основы прогнозирования эпилепсии, раннюю диагностику заболевания, обоснование и технологию применения комплексного превентивного антиэпилептического лечения больных группы риска. По времени этот период начинался с момента развертывания первого ЦП и продолжался до тех пор, пока не появлялись веские, основания для диагностики эпилепсии в качестве нозологической формы.
Основным клиническим содержанием ДПЭ является пароксизмальный синдром, динамику которого, начиная от первых пароксизмов изучали у 460 больных с бесспорным диагнозом эпилепсии. Анализ личного пароксизмального анамнеза у этих больных показал, что у 304 из них первые церебральные пароксизмы были эпилептическими припадками, которые затем, с течением времени. рецидивировали. Конкретные условия развертывания первых эпилептических припадков у различных больных оказались неодинаковыми и в целом они соответствовали тем патологическим состояниям, которые приняты в современной практической эпилептологии для обозначения эпилептических припадков, не являющихся проявлением состоявшейся формы эпилепсии, а именно: единичным спонтанным эпилептическим припадкам - (124), эпилептическим реакциям - (111) и эпилептическому синдрому в структуре текущего органического заболевания мозга - (69). У 156 больных эпилепсией первым эпилептическим припадкам предшествовали повторные, атипично протекавшие неэпилептические пароксизмы. Они систематизировались по своим названиям, традиционно сложившимся в повседневной клинической практике - ночные страхи, снохождения, аффективно-респираторные припадки, обмороки и др.
Далее, по результатам комплексного исследования больных эпилепсией, составивших первую группу наблюдений, были изучены основные характеристики заболевания - маркеры эпилепсии. Те из них, которые могли быть обнаружены при первых или немногочисленных ЦП и в частности у больных второй группы наблюдений, обозначили как факторы риска по эпилепсии высокой значимости. Эти факторы риска представляли собой констелляцию условий, при наличии которых динамика первых эпилептических припадков и повторных неэпилептических пароксизмов приобретала направление в сторону дальнейшего формирования у этих больных эпилепсии. Для того, чтобы быть пригодными для реального прогнозирования эпилепсии у больных второй группы наблюдений, искомые факторы риска должны были иметь эталонное значение, предполагающее высокую информативность, признаками которой было бы наличие минимальных сочетаний этих факторов риска у каждого больного эпилепсией. Кроме того, к эталонным факторам риска предъявлялись и другие требования, а именно: немногочисленность, преимущественно клинический характер и удобство применения в повседневной практической деятельности. У больных эпилепсией с эпилептическим характером первых ЦП, таких факторов риска оказалось 4: однократный эпилептический припадок, органическое повреждение мозга, выявленное по результатам комплексного исследования и имеющее либо актуальный характер, или перенесенное ранее, пароксизмальная активность на ЭЭГ и наследственный анамнез, осложненный по эпилепсии. У больных эпилепсией с повторными неэпилептическими пароксизмами, близко предшествовавшими развертыванию первого спонтанного ЭП, значимыми факторами риска оказались следующие: повторный характер неэпилептических пароксизмов, пароксизмальная активность на ЭЭГ, наследственный анамнез, осложненный по эпилепсии и атипизм клинических проявлений и обстоятельств развертывания пароксизмов. Этот последний фактор риска был выделен у всех 156 больных эпилепсией с неэпилёптическими пароксизмами в анамнезе, у 77% больных эпилепсией начинавшейся фебрильными припадками и состоял в следующем: иногда при первом церебральном пароксизме, но чаще при их повторении, последние не имели, или утрачивали типичные характеристики неэпилептических пароксизмов или фебрильных припадков, и с различной скоростью, иногда весьма постепенно и градуировано, приобретали клинические признаки, свойственные типичным эпилептическим припадкам, например, такие как внезапность, цикличность, стереотипность, утрата связи с бывшими очевидными при первых пароксизмах провоцирующими факторами и др. Эти признаки являлись специфичными для каждой разновидности донозологических ЦП и в пределах групповой специфичности проявлялись индивидуально у каждого больного. Таким образом, у больных эпилепсией выделено всего шесть эталонных факторов риска применимых к использованию для прогнозирования вероятного развития данного заболевания, из которых 2 оказались общими для всех больных: наследственный анамнез, осложненный по эпилепсии и пароксизмальная активность на ЭЭГ. Остальные 4 фактора риска являлись специфичными для двух основных разновидностей первых церебральных пароксизмов, а именно: для эпилептического характера припадков - однократный пароксизм и органическое повреждение мозга в анамнезе или имеющее актуальный характер; для неэпилептических пароксизмов и фебрильных припадков - повторный характер приступов и атипизм клинических проявлений и обстоятельств развертывания пароксизмов. Третьей задачей исследования, выполненной на материале первой группы наблюдений явилось определение средней продолжительности ДПЭ у детей с тем, чтобы обозначить минимальный календарный срок проведения превентивной антиэпилептической терапии больным группы риска по эпилепсии. Минимальной искомой продолжительностью считали промежуток времени от первого в жизни ребенка церебрального пароксизма до второго неспровоцированного эпилептического припадка. При эпилептическом характере припадков средняя продолжительность донозологического периода эпилепсии составляла 13±4 мес, а при неэпилептическом характере первых пароксизмов - 24 мес. Превентивную антиэпилептическую терапию назначали не менее, чем на 2 года.
В настоящей работе существует, по нашему мнению, неизбежный крен в сторону неблагоприятного исхода церебральных пароксизмов в эпилепсию, что связано со спецификой исследования, в задачи которого не входило изучение всех вариантов исхода первых церебральных приступов. Поэтому, следует специально отметить, что не только констатация первого церебрального пароксизма, но и помещение больного в группу риска по эпилепсии по разработанной в настоящем исследовании методике, не означало фатальной неизбежности заболевания этого ребенка эпилепсией. В наших наблюдениях первые эпилептические припадки имели и другие варианты исхода: присоединение неэпилептических пароксизмов, других нервно-психических расстройств и прекращение припадков с выздоровлением. Наиболее частыми вариантами исхода донозологических пароксизмов неэпилептической природы являлись продолжение их развертывания, присоединение других нервно-психических расстройств, например вегетативной дистонии, психомоторной расторможенности и др.; других клинических разновидностей неэпилептических пароксизмов, а также прекращение приступов и выздоровление больного. Кроме того, существенная особенность данного клинического варианта ДПЭ состояла в том, что неэпилептические пароксизмы далеко не всегда прекращались с развертыванием первых ЭП, а продолжались и далее, сосуществуя с последними у 60% больных. Период параллельного развертывания неэпилептических и эпилептических пароксизмов продолжался у различных больных от нескольких месяцев до нескольких лет, после чего неэпилептические пароксизмы появлялись реже и затем прекращались. Полученные данные ориентировали нас на важное предположение о возможности существования определенной степени общности неврологии и в частности, общности топического диагноза неэпилептических и эпилептических ЦП, и использованы при исследовании основ патофизиологии ДПЭ у детей.
После постановки диагноза эпилепсии, ее донозологические проявления считали законченными, поэтому, в соответствии с задачами исследования, два других основных синдрома донозологического периода эпилепсии - синдромы психических и ЭЭГ нарушений изучали у 227 больных группы риска по этому заболеванию, заболевание у которых расценивалось как находящееся еще в донозологическом его периоде.
В целом синдром психических нарушений выявлен в 72% наблюдений группы риска. Типичные нарушения психики, которые в литературе также называют специфическими, имели место у 12% больных, неспецифического типа - у 60%, а у остальных 28% cocroяние психики соответствовало возрасту. Специфические нарушения психики проявлялись эмоционально-волевыми, интелектуально-мнестических расстройствами, личностными изменениями. Все эти нарушения развивались преимущественно у больных старшего возраста, они сочетались между собой, были выражены легко и ни в одном наблюдении не вызывали выраженной возрастной дезадаптации детей. Изменения психики неспецифического характера наблюдались во всех возрастных группах, среди всех разновидностей донозологических церебральных пароксизмов и напоминали нарушения поведения и психики у больных неврозами.
При этом у 25% больных в поведении господствовали астенические проявления - повышенная утомляемость при повседневных обычных нагрузках, головные боли, нарушения сна, плаксивость, необоснованное упрямство и негативизм. У других 35% больных преобладала психомоторная расторможенность, гиперактивность, отсутствие дневного засыпания с раннего возраста, трудная управляемость поведением.
Выявленные изменения мы не связывали с наличием единственного эпилептического припадка или повторных неэпилептических пароксизмов и расценивали их в качестве клинического выражения органической патологии мозга, полученной в наших наблюдениях преимущественно в период беременности и родов.
Патофизиологию донозологического периода эпилепсии изучали по результатам комплексного исследования 227 больных группы риска в условиях детского неврологического стационара. Производилось исследование основных этиологических факторов заболевания, клинической патологии преморбидного периода, межприступного состояния и анализ основных клинических проявлений пароксизмов. Обобщались данные расспроса, анализа истории развития ребенка, данные объективного соматического, неврологического и дополнительных методов исследования, из которых самым информативным оказалась ЭЭГ. Оказалось, что лишь у 16% больных ЭЭГ представляла собой варианты возрастной нормы, а у остальных - была патологически изменена. Патологические ЭЭГ изменения подразделялись на две основные разновидности: постоянную патологическую активность, зарегистрированную у 70% и пароксизмальную патологическую активность - у 67% больных. Постоянную патологическую активность представляла медленная дельта активность (11,5%), медленная тета активность (15%), сочетание медленной дельта и тета активности (23%) и ЭЭГ признаки запаздывания созревания церебрального электрогенеза (20,5%). Постоянную патологическую активность расценивали в качестве ЭЭГ эквивалента основного этиологического фактора донозологических церебральных пароксизмов - органического повреждения мозга, полученного преимущественно в пре- перинатальном периоде развития и жизни ребенка. Топико-диагностическое значение постоянной патологической активности состояло в том, что она указывала на органическое повреждение и дисфункцию структур ЛРК - лимбической коры, промежуточного мозга и стволовой ретикулярной формации [Busier P. et al., 1972; Engel J., 1983; Gastaut H. et al., 1980].
Пароксизмальная патологическая активность была генерализованной у 33% и имела очаговый характер у 34% больных. По степени патологический выраженности преобладала условно-эпилептическая активность (58%), по сравнению с типичными эпилептическими графоэлементами (9%). Полученные данные свидетельствовали о том, что ЭЭГ корреляты донозологического и манифестного периодов эпилепсии являлись преимущественно одинаковыми. Различия состояли в том, что при развернутых клинических формах эпилепсии среди пароксизмальных форм патологический активности доминировала типичная эпилептическая активность. Подобная динамика основных форм пароксизмальной ЭЭГ активности наглядно отражала как единые патофизиологические механизмы эпилептогенеза любой его стадии, так и определенную преемственность донозологических и развернутых форм заболевания. Кроме того, современные представления о структуре большинства возможные вариантов эпилептических нейронных систем, реализующих как генерализованные, так и парциальные припадки, предполагают непременное в них участие структур ЛРК, с которыми связываются и механизмы генерирования основных феноменов пароксизмальной ЭЭГ активности [Мыслободский М.Я., 1973; Карлов В.А., 1990; Gloor P., 1982; Niedermeyer E., 1972]. Клинические же доказательства прямого участия глубинных структур мозга в патофизиологни донозологического периода эпилепсии в качествен топического диагноза, в наших наблюдениях были получены трижды, а именно: в периоде предшествовавшем развертыванию первых церебральных пароксизмов, в межприступном состоянии и посредством анализа клинических проявлений собственно пароксизмов. Полученные в результате комплексного исследования данные свидетельствовали также об определенной степени общности неврологии эпилептических и неэпилептических ЦП в донозологическом периоде эпилепсии у детей. Единство неврологии подтверждалось господствующим у всех больных группы риска этиологическим фактором - органическим повреждением мозга, полученным преимущественно в периоде беременности и родов, наследственным фактором, в виде осложнения семейного анамнеза больных по эпилепсии и другим церебральным пароксизмам, общностью клинической патологии со стороны глубинных структур мозга в преморбидном периоде, общностью клинических проявлений пароксизмов и общностью топического диагноза, состоявшего в органическом повреждении и нарушении функционального состояния структур ЛРК.
В целом, основные положения патофизиологии донозологического периода эпилепсии представлялись следующим образом. В период беременности и родов и реже в постнатальной жизни, мозг ребенка подвергался органическому повреждению, сосредоточенному преимущественно в его неспецифических системах. Эти повреждения не носили характера грубых и обширных анатомических разрушений, не препятствовали выживанию ребенка в остром периоде и не вызывали тяжелых, устойчивых состояний клинической декомпенсации в постнатальной жизни. Однако начиная с раннего детства, эти повреждения проявлялись клинической патологией, свидетельствовавшей о нарушении функционального состояния структур ЛРК. Резидуальный характер этих повреждений подтверждался высокой частотой постоянной патологической ЭЭГ активности и результатами ультразвуковых и рентгенологических методов исследования. Этот резидуальный органический фон представлял собой необходимую предиспозицию для повышения пароксизмальной готовности мозга, которая у большинства больных являлась, таким образом, приобретенной, но у некоторых из них была усилена еще и наследственным фактором. В этих условиях, порою очень рано развертывались первые ЦП. В неонатальном периоде жизни дифференцирование их природы затрудненно, однако в дальнейшем, по мере созревания мозга, они приобретали более определенный эпилептический или неэпилептический характер, сохраняя, тем не менее, у части больных, много общего в своей неврологии. Основным ЭЭГ признаком этих пароксизмов становились пароксизмальные виды патологической активности, источником которых являлись по прежнему те же, поврежденные ранее глубинные структуры мозга. Об этом свидетельствовали сочетания постоянной и пароксизмальной патологической ЭЭГ активности, зарегистрированные у 120 (52,8%) больных группы риска по эпилепсии.
Нельзя было обойти молчанием и факты, состоящие в том, что у 16,2% больных донозологические пароксизмы как неэпилептического, так и эпилептического характера развертывались на фоне возрастной ЭЭГ нормы и у 17% - на фоне лишь постоянной, но не пароксизмальной патологической ЭЭГ активности. Этим фактам может быть предложено два естественных объяснения: запаздывание ожидаемых ЭЭГ изменений по отношению к клинике, что не является большой редкостью и для манифестных клинических форм эпилепсии, а также возможность развертывания церебральных пароксизмов донозологического периода эпилепсии в условиях конституционального, физиологического уровня пароксизмальной готовности мозга.
Заключительным этапом исследования явилась разработка медицинской тактики при первых церебральных пароксизмах у детей - раздела крайне необходимого для повседневной деятельности невропатологов, психиатров и педиатров, и в то же время все еще отсутствующего в современных руководствах по эпилепсии. Основные положения разработанной медицинской тактики изложены в четвертой главе издания. Принципиальные же замечания состоят в следующем. Прежде всего, основные требования, предъявленные к медицинской тактике были следующими: универсальность и применимость к каждому больному перенесшему первый церебральный пароксизм, и в то же время сохранение индивидуального подхода, связанного с учетом характера пароксизма, профилактическая направленность и простота применения. Главная же идея состояла в признании назревшей необходимости широкого применения превентивного лечения эпилепсии с включением постоянного приема АЭП по обоснованным показаниям. Была проделана большая подготовительная работа по теоретическому и клиническому обеспечению воплощения этой идеи в реальность: выделен донозологический период эпилепсии, содержащий достаточно времени для проведения лечебных мероприятий, направленных на предотвращение развернутых вариантов заболевания, дано его патофизиологическое обоснование, исследованы клиническое содержание, диагностические критерии и продолжительность. В процессе разработки основных характеристик ДПЭ оказалось необходимым преодолеть привычные консервативные представления о безусловном разграничении и полном противопоставлении неэпилептических и эпилептических пароксизмов у всех больных и в любой ситуации. В исследовании приведены доказательства наличия определенной степени общности неврологии неэпилептических и эпилептических ЦП. Эти доказательства были получены у определенных больных находящихся в определенной клинической ситуации, а именно у больных с ЦП, протекавшими на фоне опасных сочетаний значимых факторов риска по эпилепсии и находящихся в донозологическом периоде этого заболевания. Полученные данные решительно отвергают случайный характер столь частого появления атипично протекающих неэпилептических пароксизмов в анамнезе больных эпилепсией и дают возможность расценивать последние в качестве одного из пароксизмальных вариантов клиники ДПЭ у детей. И если проведение превентивной антиэпилептической терапии больным группы риска, перенесшим единичные эпилептические припадки имеет своей целью остановить процесс эпилептогенеза в донозологическом его периоде, то подобное обоснованное лечение больных с атипично протекающими неэпилептическими пароксизмами, направленное на предотвращение развертывания первого классифицируемого эпилептического припадкам имеет еще более выраженную профилактическую направленность в связи с тем, что предоставляет возможность купирования эпилепсии у детей еще на продромальной стадии заболевания.
СПИСОК ЛИТЕРАТУРЫ
Абрамович Г.Б. Эпилепсия у детей и подростков. -Медицина, 1965. -107 с.
Абрамович Г.Б. Тачанов И.Л. О значимости различных патогенных факторов в происхождении эпилепсии у детей подростков. //Журнал невропатологии и психиатрии. -1969. №4. -С. 553-556
Абрамович Г.Б. Харитонов Р.А. Эпилептические психозы у детей и подростков. -Л.: Медицина, 1979. -142 с.
Акимов Г.А., Ерохина Л.Г., Стыкан О.А. Неврология синкопальных состояний. -М.,1987.-207с
Алимов И.Ю. Судорожный синдром и эпилепсия у детей. Душанбе: «Ифрон», 1988. 110 с.
Асанова Л.М-Б. Пароксизмальные расстройства у детей. -Автореф. дисс. доктора мед. наук. -М. 1990. -34 с.
Бейн Б.Н., Журавлева Л.А., Перунова Н.Ю. Роль компьютерной томографии при поражении головного мозга у больных с эпилептическими припадками. //Журнал невропатологии и психиатрии -1990. -№6. -С. 25-29.
Бибилейшвили Ш.И., Геладзе Т.Ш. клиника и лечение эпилепсии сна. -Тбилиси, 1979. -26 с.
Биниауришвили Р.Г. Эпилепсия и неспецифические системы мозга. Автореф. дисс. доктора мед. наук. -М., 1985. -39 с.
Благосклонова Н.К., Новикова Л.Н. Детская клиническая электроэнцефалография. -М., 1994. -202 с.
Болдырев А.И. Начальные проявления эпилепсии у взрослых. Автореф. дисс. доктора мед. наук. -М., 1967. -32
Болдырев А.И. Эпилепсия у взрослых. -М., 1984. -288 с.
Болдырев А.И. первые пароксизмальные проявления эпилепсии у детей. //Журнал невропатологии и психиатрии. -1987. -№6. -С. 828-832.
Болдырев А.И. Лечение детей и подростков в начальной стадии эпилепсии. //Журн. невропатологии и психиатрии. -1988. -№6. -С. 861-866.
Болдырев А.И. Эпилепсия у детей и подростков. -М., 1990. -317 с.
Бондаренко Е.С., Эдельштейн Э.А., Мизикова И.З. Эпилепсия у детей. -М., 1982. -13 с.
Буздин В.В. Ночные страхи как инициальные проявления эпилепсии у детей. //Всесоюзная конференция по организации психиатрической и неврологической помощи детям. -М., 1980. С. 224-225.
Буздин В.В. Эпилепсия с приступами во время сна. Автореф. дисс. канд. мед. наук. -Л., 1989. -С. 22.
Бурцев Е.М., Максимов О.Г., Стародубцев А.В. О нейросоматической основе вегетативно-сосудистых дистоний //Клиника, диагностика и лечение нейрогенных соматических заболеваний. -Пермь, 1981. -С. 28-29.
Бурд Г.С. Международная классификация эпилепсии и основные направления ее лечения. //Журнал невропатологии и психиатрии. -1995. -№3. -С. 4-12
Буркова А.С., Ямпольская Э.И., Землянская З.К. Диагностическое и прогностическое значение ряда неврологических синдромов у новорожденных и грудных детей //Врожденная и наследственная церебральная патология у детей. -М., 1980. С. 28-31.
Вейн А.М., Карлов В.А. О так называемой гипоталамической или диэнцефальной эпилепсии. //Журнал неврологии и психиатрии. -1980. -№6. -с. 939-941.
Вейн. А.М., Хехт К. Сон человека. Физиология и патология. -М., 1991. -272 с.
Вейн А.М. Заболевания вегетативной нервной системы. -М., 1991. -624 с.
Воронков Г.Л. К проблеме дебютов и ранней диагностике эпилепсии. Автореф. дисс. канд. мед. наук. -Киев.1972. -32 с.
Гедекова А. Клинико-электроэнцефалографические критерии ранней диагностики эпилепсии у детей и подростков //Автореф. дисс. канд. мед. наук. -М., 1989. -23 с.
Геладзе Т.Ш. Гиперактивное поведение детей как осложнение антиэпилептического лечения //Журнал невропатологии и психиатрии. -1988. -№6. С. 17-21.
Гельниц Г., Курт, Кнаапе Г. Об отношении ночных страхов к страхам у детей при эпилепсии //Проблемы психоневрологиидетского возраста. -М., 1964. -С. 461-476.
Гисматулина Р.Г. К клинике начальной стадии эпилепсии у детей //5-й Всесоюзный съезд невропатологов и психиатров. -М., 1969. Т.2, С. 32-34.
Гольбин А.Ц. Патологический сон у детей. -П.: М., 1979. -248 с.
Громов С.А., Иноземцева В.С., Макаридзе М.З. Церебральные вегетативные пароксизмы. -Саранск., 1991. -117 с.
Гузеева В.И. Эпилептические и неэпилептические пароксизмы у детей раннего возраста (клиника, диагностика и лечение). Автореф. дисс. канд. мед. наук. -П. 1983. -20 с.
Гузева В.И. Пароксизмальные расстройства сознания у детей раннего возраста (диагностика и реабилитация). Автореф. дисс. доктора мед. наук. -С-Петербург, 1992. -37 с.
Гусев Е.И., Бурд Г.С. эпилепсия. -М., 1994. -63 с.
Елигулашвили Т.С. Биниауришвили Р.Г. Динамика слуховых стволовых соматосенсорных вызванных потенциалов, у больных эпилепсией и обмороками под влиянием депривации сна. -М., 1985 -С. 118-119.
Ерохина Л.Г., Григорьева Л.С. К патогенезу синкопальных состояний //Пароксизмальные вегетативные нарушения _М., 1979. -С. 223-224.
Ерохина Л.Г., Григорьева Л.С. Эффективность применения противоэпилептических средств при некоторых типах синкопальных состояний //Проблемы клинической и экспериментальной фармакотерапии и лекарственные осложнения. -Тбилиси, 1979. -С. 120-122.
Ерохина Л.Г., Григорьева Л.С. К вопросу о соотношении обмороков и эпилепсии.//Труды 2-го Московского медицинского института. -1980. -Т. 146, вып. 9. С. 101-106.
Ерохина Л.Г., Григорьева Л.С. Роль стволовых структур в генезе эпилептических пароксизмов, феноменологически сходных с синкопами //2-й съезд невропатологов и психиатров Белорусии. -Минск, 1980. -С. 187-188.
Ерохина Л.Г., Стаховская А.С. К клинике и патогенезу транзиторной глобальной амнезии //7-й Всероссийский съезд неврологов. -Нижний Новгород, 1995. -387 с.
Зенков Л.Р. Клиническая электроэнцефалография с элементами эпилептологии. – Таганрог, 1996. -357 с.
Искандер М.Б. Дифференцированная терапия эпилепсии у детей //Автореф. дисс. канд. мед. наук. -М., 1993. -22 с.
Карлов В.А. Эпилепсия. -М., 1990. -336 с.
Карлов В.А. Эпилепсия сегодня //7-й Всероссийский съезд неврологов. -Нижний Новгород. -1995. -396 с.
Карлов В.А. пароксизмальные состояния в неврологической клинике: дефиниции, классификация, общие механизмы патогенеза //7-й Всероссийский съезд неврологов. -Нижний Новгород. -1995. -397 с.
Кельин Л.Л., Буздин В.В. пароксизмальные состояния у детей, как факторы риска заболевания эпилепсией //Лечение и реабилитация больных с пограничными нервно-психическими заболеваниями и алкоголизмом. -М., 1987. -С. 130-138.
Кельин Л.Л. Пароксизмальные расстройства сознания как преморбидные проявления эпилепсии у детей. //Автореф. дисс. канд. мед. наук. -Л., 1990. -24 с.
Ковалев В.В. Психиатрия детского возраста. -М., 1979. -608 с.
Ковалев В.В., Белов В.П., Венцовски Е. Эпилепсия //Руководство по психиатрии. -Т.1. -М., 1988. -С. 516-558.
Коровин А.М. Судорожные состояния у детей. -Л., 1984. -222 с.
Кравцов Ю.И., Малов А.Г. Нарушение ночного сна при височной эпилепсии у детей по данным полиграфического исследования //Новые технологии в неврологии и нейрохирургии: Самарская медицинская конференция невропатологов и нейрохирургов. -Самара, 1992. -С. 79-80.
Макаридзе М.Г., Окуджава В.М. К эпилептогенезу в гипоталамусе //Журн. невропатологии и психиатрии. 1989. -№6. -С. 9-13.
Миридонов В.Т., Корж Г.С., Лысеченкова О.В. Факторы риска по эпилепсии у детей //Профилактическая и реабилитационная неврология и психиатрия. -Пермь, 1988. -С. 58-59.
Миридонов В.Т. Клиническая картина и диагностика донозологических проявлений эпилепсии у детей //6-й Всероссийский съезд психиатров. -М., 1990 -С. 94-97.
Миридонов В.Т. Церебральные пароксизмы в детской неврологической клинике. -Пермь, 1994. -191 с.
Миридонов В.Т. Дифференциальная диагностика и прогностическое значение пароксизмальных нарушений сна у детей //Актуальные вопросы клинической педиатрии, акушерства и гинекологии. -Киров, 1992. С. 57-58.
Миридонов В.Т. Неврология неэпилептических церебральных пароксизмов у детей //Пермский медицинский журнал 1995. -№4. -С. 15-18.
Миридонов В.Т. Донозологический период эпилепсии у детей (клинико-электроэнцефалографическое исследование). -Автореф. дисс. доктора мед. наук. -Иваново, 1996. -44 с.
Мурадян Г.Т. Эпилепсия у детей и подростков. Ереван, 1976. -168 с.
Мыслободский М.С. Гиперсинхронные ритмы коры больших полушарий. -М., 1970. -39 с.
Наджаров П.А., Шумский Н.Г. О скрытой эпилепсии //Вопр. психиатр., 1960. -№4. -С. 90-105.
Натриашвили Г.Д. Аффективные респираторные пароксизмы у детей //Пробл. невропат., психиатр. и наркологии. Тбилиси, 1987. -С. 226-230.
Пазюк Е.М. Клинико-гениалогическое исследование мигрени, эпилепсии и их ассоциированных форм //7-й Всероссийский съезд неврологов. Нижний Новгород, 1995. -418.
Петрухин А.С., Мухин К.Ю., Хомякова С.Л. Особенности течения доброкачественной фокальной (роландической) эпилепсии у детей. //7-й Всероссийский съезд неврологов. Нижний Новгород, 1995. -419 с.
Полиграфическое исследование ночного сна и вызванных потенциалов при синкопальных пароксизмах /Геладзе Т.Ш., Вирсаладзе М.Д., Джибладзе М.Г., Николаишвили Р.Г. //Всеросоюзная научная конференция по актуальным вопросам физиологии и патологии сна. _М., 1995. -С. 105-107.
Поповиченко Н.В., Расин С.Д. Нейрогормональные взаимоотношения и их нарушения при эпилепсии у детей и подростков. Киев, 1977. -139 с.
Ратнер А.Ю., Сафиуллина Ф.К., Хатеева З.Б. Об отношении фебрильных и аффективно-респираторных судорожных состояний у детей к эпилепсии //Педиатрия, 1987. -№4. -С. 45-48.
Ратнер А.Ю. Особенности и дискуссионные проблемы эпилепсии у детей раннего возраста //Пароксизмальные состояния у детей. Пермь, 1989. -С. 49-51.
Рогачева Т.А. Применение профилактической терапии у детей с наследственно отягощенностью по эпилепсии //5-й Всероссийский съезд невропатологов и психиатров, 1985. Т.3. -С. 318-320.
Рогачева Т.А. Нервно-психические расстройства у детей, родители которых страдают эпилепсией //Автореф. дисс. канд. мед. наук. -М.. 1987. -14 с.
Сараджишвили П.М., Геладзе Т.Ш. Эпилепсия. -М., 1977. -304 с.
Сафиуллина Ф.К. Аффективно-провоцируемая эпилепсия //Перинатальная неврология. Казань, 1983. -С. 181-182.
Сафиуллина Ф.К. Лечение детей с аффективно-респираторно-провуцируемой эпилепсии //Перинатальная неврология. Казань, 1983. -С. 182-183
Свмрмдова Е.И., Владимирова С.М. Психические нарушения у больных мигренью. // Журн. невропат. и психиатр. 1986. №6. -С. 910-913.
Свиридова Е.И., Калашникова Л.А., Асанова Л.М. Бессудорожные пароксизмы при эпилепсии и мигрени //Журн. невропат и психиатр., 1990. №6. -С. 3-5
Свиридова Е.И. Детская эпилепсия, ее особенности //6-й Всероссийский съезд психиатров, 1990. -Т.2. -С. 33-35.
Федорова М.П. Потеря сознания у больных мигренью. // Журн. невропат. и псиатр., 1978. -№1. -С. 35-41.
Харитонов Р.А.. Рябинин М.В.. Богаев В.И. Некоторые вопросы диагностики инициальных форм эпилепсии у детей. //Совр. методы исследования и лечение больных эпилепсией. -Л., 1989. -С. 6-10.
Харитонов Р.А., Кельин Л.Л. Принципы донозологической дифференциации больных с фебрильными судорогами //6-й Всероссийский съезд психиатров. -М., 1990. -Т.2. -С. 45-47.
Харитонов Р.А., Рябинин М.В., Кельин Л.Л. Аффективно-респираторныке приступы (клиника, патогенез и реабилитация). //Журн. невропат. и психиатр., 1990. -№6. -С. 5-9.
Хашимов Р. Диагностическое значение ЭЭГ у больных с пароксизмальными расстройствами сна. //Всесоюзная научная конференция по актуальным вопросам физиологии и патологии сна. -М., 1985. -С. 176-177.
Шамансуров Ш.Ш., Рафикова З.Б. Пароксизмальные нарушения сознания у детей раннего возраста. Ташкент, 1990. -126 с.
Шанько Г.Г. Эпилепсия и пароксизмальные состояния у детей //Неврология детского возраста. -Минск, 1990. -С. 228-312.
Aicardi J. The prevention of epilepsy in children. //Epileptology /Eds. D. Janz. -Stutgart, 1976. -p. 2-9.
Aird R.B., Masland R.L., Woodbury D.M. The epilepsies: A critical review. -New York: Raven Press, 1984. -309 p.
Alring I. Classification of epilepsies end epileptic seizures: an investigation of 2100 out patients //Epilepsy international congress. (Kyoto Japan), 1981. -p. 61-71.
Annegers J.F. Factors prognostic of anprovoked seizures after febril convulsions //New Engl. J. Med., 1987. -V.26. -p. 493-498
Annegers J.F., Hauser W.A. The risk of seizure disorders of patient with epilepsy //Epilepsy, pregnancy end the child /Eds. D. Janz. -New-York, 1982 -p. 509-514
Bancaud J. Epilepsies// Encyclopedie Med. Chir. -Paris, 1976. A 10-30.
Bancaud J., Bacia T., Sierpinski V. Les crises epileptiques dites. Electriquement silensieueses //Rev. Neurol. -1968. -118. -p. 481-487.
Besser R., Kramer G. Interval der ersten Anfalle bei Spatepilepsien //Epilepsy. -1981. /Hrsg. H. Renschmidt et al. -New-York, 1983. -s. 108-113.
Betts T. Pseudo seizures: seizures that area not epilepsy //Lancet. 1990. №8708. -p. 163-164.
Broeker H., Wuller D., Wilbner B. Grund zuger von diagnostik, therpie, Verlauf und Prognose bei Kombination epileptiseher und psychogener Anfalle // Z. K. V. -Berlin, 1989. -Heft 19. -s. 1695-1699.
Bussier P., Bancaud J., Talairach J. Electrophysiolodgycal studies on the limbic systems with multiple multiliat stereotaxic electrodes in epileptic patients //Neurophisyology studied in man /Exepta Medica Fundation. -Amst., -1972. -V.6. -p. 16-25.
Cadchillac J. Sleep and epilepsy. -New York. -1982. P. 315-324.
Camfield P.R., Camfield C.S., Dooley F.R. Epilepsy after the first unprovoked seizures in childhood. //Neurology. -1985. -V.II. -p. 1657-1660.
Cavazzuti G.B., Cappela L., Nalin A. Longitudinal studi of epileptiform EEG patterns in normal childrens //Epilepsia. -1980. -V.21. -P.43-45.
Cleland P.G., Steward W.D., Mosqura I. Prognosis of isolated seizures in adult life //Br. Med. J. -1981. -V.4-№2.-P.1364-1368.
Coc Ch.J., Lee Y.N. Organic disordes in childrens with epileptic seizures //Acta. Pediatr. Jap. -1989. -V.31. -№3. -P.267-272.
Colomy J.P. Approach to the patient with a single seizure. //Postgrad. Med. -1980. -V.68. -№5. -p. 12-17
Curatolo P., Carboni P., Brinciotti M. La patologia convulsiva ad insorgenza entro il 2 anno di vitro //Riv. Pediat. prevent. -1980. -V.30. -№1. -P.67-72.
Eadie M.J., Lander C.M., Hooper W.D. Factors influensing plasma phenobarbitone level in epileptic patient //Brit. J. Clin. Pharmacol. -1977. -V.4. -P.541-547.
[Eadie M.J., Tyrer D.X.] Эди М.Ж., Трайер М.Х. противосудорожная терапия: Пер. с английского. -М., 1983. -384 с.
Engel J. Functional localisation of epileptogenic lesions //Trends. Neurol., 1983. -V.6. -P.60-65.
Ericsson M., Zetterztrцm R. Neonatal convulsions //Acta. pediatr. scand. -1979. -V.68. -№6. -P. 807-811.
Gastaut H. Epilepsias. -Buenos Aires. 1970. -138 p.
[Gastaut H.] Гасто А. Терминологический словарь по эпилепсии. т.1. -М., 1975. -90 с.
Gastaut H., Naqet R., Gastaut J.L. L`electroencephalographie clinique en neurologie //Ancycl. Med. Chir. -Paris, 1980. -17031. -A-10, A-30.
Geets W. Cephalie epileptique //Acta neurol. Belg., 1972. -V.72. -№1. -P.1013.
Gloor P. Toward a unitying concept of epileptogenesis //Advances in epileptology: 13-th epilepsy international symposium. -New York, 1982, -P. 83-85
Glossary of term most commonly used by clinical electroencephalographers //Electroenceph. Clin. Neurophysiol., 1974. -V.37. -P. 538-548.
Hallstrom T. Night terror in adults througthree generations //Acta psichiat. -1972. -V.48. -№4. -P. 350-352.
Hagberg G., Hansson O. Childhood seizures //Lancet. -1976. -№2.-P.208-209.
Hart R.G., Faston J.D. Seizure recurrence after a first, unprovoked seizure. //Arch. Trop. Paediatr. -1994. -V.14. -№4. -p. 303-308
Hauser W.A. The prevalanse and insidence of convulsive disorders in children. //Epilepsia. -1994., V.35. -suppl.2 -p. 1-6
Janz D. Die Epilepsien. -Stuttgart: Tiemme, 1969. -128 s.
Janetti P., Ottaviano S., Allemand F. Le convulsioni nei primi tre giorni de vitra //Gaslini. -1975. -V.7. -P. 70-71.
Janz D., Schefner D. Ьber Epileptische Anfalle bei Kinder von Eltern mit Epilepsie //Nervenarzt. -1980. -Bd51. -№4. S. 226-232.
Janz D., Doose H., Anderson V. Genetics of the epilepsies //Proceeding of Workshop. -Berlin: Springer, 1986. -P. 195-200.
Jasper H. The ten-twenty electrode system of the international federation //EEG Clin. Neurophysiol. -1958. -V.10. -P. 371.
Jansen H. Subclinical epileptic seizures in children. The diagnostic value of a short test programmer during simultancous EEG and videomonitoring //Acta pediatr. scand., 1987. -V.76. №1. -P.136-166.
Jeras J., Tivadar I. Epilepsies in children. -Hannover, 1973. -305p.
Jonson L.C. Sleep and epilepsy. New York, 1982. -P. 381-394.
Johnstone M. Vasovagal syncope //Brit. Med. J. -1976. -V.2. -№6042. -P.1008-1009.
Keen J.H., Lee D. Sequelas of neonatal convulsions. -Arch. Dis. Childr. -1973. V.48. -№5. -P.394-400.
King D.W., Gallager B.B., Murvin A.J. Pseudoseizures: diagnosticevalution //Neurology (N.Y.), 1982. -V.32. -№1. -P.18-23.
[Kreindler A., Krighel E., Stoica F.] Детская эпилепсия. (Пер. с румынского). Бухарест. -1963. -269 с.
Kumamoto R. A clinical study the late onset epilepsy. //Psychyat. Neurol. Japan. -1971. -V/37. -№11-12. -P.908-909.
Laditan A.A. Seizures recurrence after a first febrile convulsion. //Ann. trop. Paediatr. -1994. V.14. -№4. -p. 303-308
Lehovsky M. Affectivne respirachich kreci. -Cs. Pediat. -1977. -V.24. -№6. -P.467-473.
Laugaresi E., Cirignotta F. //Sleep. -1981. -V.4. -№2. -P.30-35.
Majkowski J. Padaczka. Electroencephalographia kliniczna. -Warzsawa, 1986. -P. 142-158.
Majkowski J. Padaczka. Diagnostica. Leczenie. Zapobieganie. - Warzsawa, 1986, -344 p.
Matthes A. Epilepsien: Diagnostik und Terapie fьr klinik und praxis. -Stuttgart: New York, 1984. -P. 306.
Nelson K.B., Ellenberg J.H. Prognosis in children with febrile seizures //Pediatrics. -1978. -V.61. №5. -P. 720-727.
Nelson K.B., Ellenberg J.H. Antecedents of seizures disorders in early childhood. //Amer. J. dis. child. -1986. -V.1400. -№10. -P.1053-1061.
Niedermeyer E. The generalized epilepsies. A clinical electroencephalographic study. -Tomas, Springfild. -1972. -247 p.
Passouant P. Le rhnencephal. -Ancycl. Med. Chir., 17003. -A-40, Paris. -1974.
[Penfield W., Jasper H.] Пенфилд У., Джаспер Т. Эпилепсия и функциональная анатомия головного мозга человека: Пер. с англ. -М., 1958. -408 с.
Roob R.R., Ekman P.B. Abdominal epilepsy //J. Amer. Med. Ass. -1972. -V.222. №1. P. 65-66.
Schmidt D. Behaudlung der Epilepsien: medicamentos, psychosozial, operativ. -Stuttgart. -1984. -2669.
Schmitt J. Crises nerveuses non epileptiques //Encycl. Med. Chil. -Paris. -1979. -17045. -A-60.
Servit Z. Epilepsie. Grundlagen einer evolutionaren Pathologie. -Berlin. -1963. -278 s.
Voiculescu V., Sirian S., Ungher J. Concomitant cortical and hipothalamic experemental epileptic foci in cat. //Neurol. et Psych. (Buc.). -1980. -V.18. -№2. -P. 93-99.
Whitty C.W. Migraine variants //Brit. Med. J. -1971. -Jan. -P. 38-40.
Wolf P. Einfuhrung in die practische Epileptologie. -Weinhein, Basel: Beltz Verlug. -1984-143 s.


 №№
№№ №№
№№ №№
№№