 Статья: Протеомика
Статья: Протеомика
Статья: Протеомика
А.А. ЗАМЯТНИН, доктор биологических наук, Институт биохимии им. А.Н.Баха РАН
Наш рассказ будет посвящен одной из самых молодых фундаментальных наук (если не самой молодой), которая родилась всего лишь несколько лет назад вместе с теми, кто еще сейчас учится в начальной школе. В отличие от многих других наук о протеомике можно точно сказать, при каких обстоятельствах она возникла, указать год, когда появилось ее название и кто его придумал.
Начнем с обстоятельств. Во второй половине XX в. бурно развивались аналитические методы биохимии, молекулярной биологии и вычислительной техники. Выдающиеся успехи, достигнутые в этих областях, привели к возможности расшифровки огромных последовательностей оснований нуклеиновых кислот и к записи полного генома живого организма. Впервые полный геном был расшифрован в 1980 г. [1] у бактериофага phi Х-174 (около 5·103 оснований), затем у первой бактерии – Haemophilus influenzae (1, 8·106 оснований) [2]. А c завершением XX в. была закончена грандиозная работа по расшифровке полного генома человека – выявлению последовательности примерно 3 млрд оснований нуклеиновых кислот [3]. На эту работу было затрачено несколько миллиардов долларов (примерно по одному доллару на одно основание). Всего же уже расшифрованы геномы нескольких десятков видов живых организмов. Именно в этот период возникли две новые биологические науки: в 1987 г. впервые в научной печати было использовано слово «геномика» [4], а в 1993 г. – «биоинформатика» [5].
У каждого биологического вида часть генома представлена участками, кодирующими аминокислотные последовательности белков. Например, таких участков у человека насчитывается порядка 100 000 (по некоторым оценкам, это число может достигать 300 000, а с учетом химически модифицированных структур – нескольких миллионов). Казалось бы, зная полный геном и генетический код, можно путем трансляции получить все сведения о структуре белков. Однако все не так просто. Постепенно становилось очевидным, что в данной рассматриваемой клеточной системе организма нет корреляции между наборами мРНК и белков. Кроме того, многие белки, синтезированные на рибосомах в соответствии с нуклеотидной последовательностью, после синтеза подвергаются химическим модификациям и могут существовать в организме в модифицированной и немодифицированной формах. И еще немаловажно то, что белки обладают разнообразными пространственными структурами, которые на сегодняшний день нельзя определить по линейным последовательностям нуклеотидов и даже аминокислот. Поэтому прямое выделение и определение структур всех функционирующих белков остается по-прежнему актуальной задачей (прямое определение структуры на сегодняшний день осуществлено примерно лишь для 10% белков человека). Так, в дополнение к геномике появился термин «протеомика», объектом исследования которой является протеом (от англ. PROTEins – белки и genOMe – геном). А в научной печати упоминание о протеоме впервые появилось в 1995 г. [6].
Следует добавить, что большую роль в жизнедеятельности организмов играют многочисленные короткие фрагменты белковых предшественников, которые называются олигопептидами, или просто пептидами. Именно из-за них наблюдается такой разнобой в оценке количества белково-пептидных компонентов у представителей одного биологического вида. Поэтому наряду с терминами «протеом» и «протеомика» в настоящее время уже употребляются такие термины, как «пептидом» и «пептидомика», представляющие собой часть протеома и протеомики. О многообразии структуры и функций белков и пептидов на страницах газеты «Биология» нами было рассказано ранее [7].
Итак, сформулируем определения новых наук, которые появились при жизни нынешнего молодого поколения и которые тесно взаимосвязаны друг с другом (рис. 1).
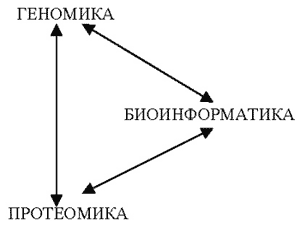
Рис. 1. Схема, иллюстрирующая полную взаимосвязь трех новых биологических наук
Геномика – наука, занимающаяся изучением структуры и функций генов (геном – совокупность всех генов организма).
Биоинформатика – наука, занимающаяся изучением биологической информации с помощью математических, статистических и компьютерных методов.
Протеомика – наука, занимающаяся изучением совокупности белков и их взаимодействий в живых организмах (протеом – совокупность всех белков организма).
Отметим также, что протеомика в общих чертах включает в себя структурную протеомику, функциональную протеомику и прикладную протеомику, которые мы рассмотрим в отдельности.
Структурная протеомика
Наиболее яркой особенностью биологии является разнообразие. Оно просматривается на всех уровнях биологической организации (биологические виды, морфология, химическая структура молекул, сеть регуляторных процессов и т.д.). В полной мере это относится и к белкам. Масштаб их структурного разнообразия до сих пор до конца не выявлен. Достаточно сказать, что число аминокислотных остатков в одном белке может составлять от двух (минимальная структура, имеющая пептидную связь) до десятков тысяч, а белок титин человека содержит 34 350 аминокислотных остатков и на сегодняшний день является рекордсменом – самой крупной из всех известных белковых молекул.
Чтобы получить сведения о протеоме, необходимо сначала его выделить и очистить от других молекул. Поскольку число белков во всем протеоме (т.е. во всем организме) весьма велико, обычно берут только часть организма (его орган или ткань) и различными методами выделяют белковую компоненту. За почти 200-летнюю историю изучения белков разработано множество методов выделения белков – от простого солевого осаждения до современных сложных методов, учитывающих различные физические и химические свойства этих веществ. После получения чистой фракции индивидуального белка определяется его химическая структура.
В структурной протеомике проводится определение структуры не одного, а сразу множества белков, и к настоящему времени для этого разработан специальный цикл процедур и создан арсенал соответствующих высокоточных приборов. (Полный набор оборудования для протеомных исследований стоит более одного миллиона долларов.)
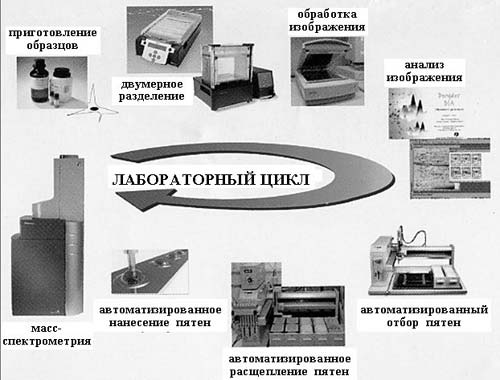
Рис. 2. Инструменты протеомики
На рис. 2 приведена схема лабораторного цикла от приготовления образца до определения его структуры. После выделения и очистки (на рисунке представлен уже выделенный и очищенный препарат) с помощью двумерного электрофореза проводится разделение белков. Это разделение идет по двум направлениям: в одном разделяются молекулы белка, имеющие разную массу, в другом – различный суммарный электрический заряд. В результате этой тончайшей процедуры на специальном носителе одинаковые молекулы группируются, образуя макроскопические пятна, причем в каждом пятне содержатся только одинаковые молекулы. Число пятен, т.е. число разных белков или пептидов, может составлять многие тысячи (рис. 3, 4), и для их исследования используются автоматические устройства для обработки и анализа. Затем проводится отбор пятен и введение содержащихся в них веществ в сложнейший физический прибор – масс-спектрометр, с помощью которого и определяется химическая (первичная) структура каждого белка.
![Рис. 3. Пример двумерной электрофореграммы белков из экстракта печени мыши [8]](/image/76930_2_1.jpeg)
Рис. 3. Пример двумерной электрофореграммы белков из экстракта печени мыши [8]
![Рис. 4. Пример двумерной электрофореграммы пептидов из цереброспинальной жидкости человека [9]](/image/76930_3_1.jpeg)
Рис. 4. Пример двумерной электрофореграммы пептидов из цереброспинальной жидкости человека [9]

Рис. 5. Нуклеотидная последовательность гена, кодирующего сывороточный альбумин человека
Первичную структуру белка можно также определить, пользуясь результатами геномики и биоинформатики. На рис. 5 дана полная структура гена сывороточного альбумина человека. Она содержит 1830 азотистых оснований, кодирующих 610 аминокислотных остатков. Этот ген, как и абсолютное большинство других, начинается с кодона atg, кодирующего остаток метионина, и заканчивается одним из стоп-кодонов, в данном случае taa. Таким образом кодируется структура, состоящая из 609 аминокислотных остатков (рис. 6). Однако эта структура – молекула еще не сывороточного альбумина, а лишь его предшественника. Первые 24 аминокислотных остатка представляют собой так называемый сигнальный пептид, который при переходе молекулы из ядра в цитоплазму отщепляется, и только после этого образуется структура сывороточного альбумина, получаемая при выделении этого белка. В итоге данная молекула содержит 385 аминокислотных остатков.
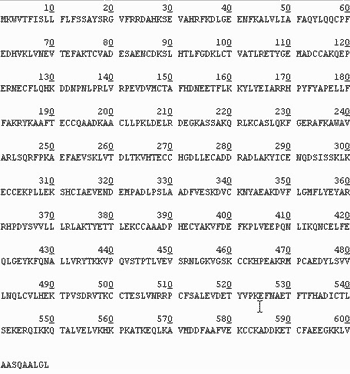
Рис. 6. Аминокислотная последовательность предшественника сывороточного альбумина человека, транслированная с нуклеотидной последовательности с помощью генетического кода
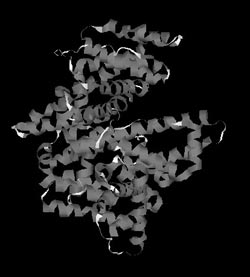
Рис. 7. Пространственная (третичная) структура молекулы сывороточного альбумина человека
Однако аминокислотная последовательность не раскрывает пространственную структуру белка. С точки зрения термодинамики, вытянутая линейная структура энергетически невыгодна, и поэтому она специфическим для каждой последовательности образом сворачивается в уникальную пространственную структуру, которая может быть определена с помощью двух мощных физических методов – рентгеноструктурного анализа и метода ядерного магнитного резонанса (ЯМР-спектроскопии). С помощью первого из них определены пространственные структуры уже нескольких тысяч белков, в том числе и сывороточного альбумина человека, изображение которого представлено на рис. 7. Эта структура, в отличие от первичной (аминокислотной последовательности), называется третичной и в ней хорошо видны спирализованные участки, являющиеся элементами вторичной структуры.


