 Реферат: Содержание аскорбиновой, дегидроаскорбиновой и дикетогулоновой кислот в эритроцитах здоровых детей и страдающих инсулинзависимым сахарным диабетом
Реферат: Содержание аскорбиновой, дегидроаскорбиновой и дикетогулоновой кислот в эритроцитах здоровых детей и страдающих инсулинзависимым сахарным диабетом
Итогом всех реакций гликолиза является превращение 1 молекулы глюкозы в 2 молекулы молочной кислоты с одновременным превращением 2 молекул ADP в 2 молекулы АТР.
Наряду с гликолизом – анаэробным расщеплением глюкозы до молочной кислоты – в эритроцитах существует дополнительный путь утилизации глюкозы – прямое окисление до углекислого газа и воды в ходе пентозофосфатного цикла. Этот путь неотличим от подобных процессов, протекающих в других клетках и тканях; суммарным результатом цикла является окисление одной из 6 молекул глюкозо-6-фосфата до 6 молекул СО2 и восстановление 12 молекул NADPH. Роль пентозного цикла в зрелых эритроцитах заключается, с одной стороны, в образовании пентозофосфатов. В реакции цикла образуется 3-глицероальдегидфосфат, подвергающийся превращениям в цепи гликолитических реакций и, таким образом, является дополнительным источником энергии. Основное значение пентозофосфатного цикла заключено в образовании молекул NADPH. Значение NADPH определяется его участием в ряде реакций, необходимых для поддержания функциональной активности и целостности эритроцитов. К ним относятся восстановление метгемоглобина в гемоглобин при участии NADPH и метгемоглобинредуктазы и восстановление окисленного глутатиона с помощь. NADPH- глутатионредуктазы. Восстановленный глутатион (GSH), форма со свободно реагирующей тиоловой группой составляет в эритроцитах до 96% общего количества. Сохранение глутатиона в восстановленном состоянии необходимо для предохранения ряда ферментов, содержащих SH- группы, от инактивации, ограждение мембраны клетки от действия перекисей и необратимого окислительного денатурирования гемоглобина.
1.1.3. Антиоксидантная система эритроцитов
Основная функция эритроцитов – транспорт кислорода от лёгких к тканям и СО2 в обратном направлении. Благодаря высоким концентрациям кислорода и постоянно протекающим процессам оксигенации – деоксигенации гемоглобина, в этих клетках с высокой скоростью идут процессы образования свободных радикалов: Н2О2, ОН-. Кроме того, в эритроцитах в результате аутокаталитических реакций образуются перекиси и гидроперекиси липидов.
Основное количество О2- в эритроцитах образуется при аутоокислении гемоглобина в метгемоглобин. Это пример генерации супероксидного радикала, связанной с неферментативным окислением субстрата:
Hb + O2 Û Hb…O2 Û MetHb + O2-
Большую роль в защите клетки от свободных радикалов играют ферментативные антиоксиданты. Эритроциты содержат высокоактивную супероксиддисмутазу, которая осуществляет дисмутацию двух O2- с образованием перекиси водорода:
O2- + O2- Û H2O2 + O2
Образовавшаяся перекись водорода, являющаяся сильнейшим окислителем, частично нейтрализуется неферментативным путём при непосредственном участии аскорбата или других антиоксидантов (a-токоферол, глутатион восстановленный). Основное количество Н2О2 расщепляется в реакциях, катализируемых каталазой и глутатионпероксидазой:
Н2О2 + Н2О2 Þ 2Н2О + О2
Н2О2 + RH2 Þ 2Н2О + R
Важную роль в антиоксидантной системе эритроцитов играют легкоокисляющиеся пептиды, содержащие аминокислоты с SH-группой: метионин, цистеин. Особое место занимает глутатион – трипептид, образованный цистеином, глутаматом, глицином. В организме он присутствует в окисленной и восстановленной форме (GSH). Основной антиоксидантный эффект глутатион оказывает, участвуя в работе ферментативных антиоксидантов. Глутатион является ингибитором активированных кислородных радикалов и стабилизатором мембран. Это связано с тем, что SH- содержащие соединения подвергаются окислению в первую очередь, что предохраняет от окисления другие функциональные группы.
Немаловажный вклад в защиту клетки от органических радикалов вносят неферментативные антиоксиданты. Эффективными перехватчиками органических радикалов являются фенольные антиоксиданты, имеющие в структуре ароматическое кольцо, связанное с одной или несколькими гидроксильными группами. Имеется несколько тысяч фенольных соединений, обладающих антиоксидантным эффектом: витамины группы Е и К, триптофан, фенилаланин, убихиноны, большинство животных и растительных (каротиноиды, флавоноиды) пигментов. Синтезируется ароматическое кольцо только у высших растений и микроорганизмов, поэтому многие из фенольных антиоксидантов входят в группу облигатных пищевых, которые эффективно ингибируют О2- , ОН- и индуцируемые ими процессы перекисного окисления (Оксенгендлер, 1985).
Антиоксидантными свойствами обладают хелатные соединения, связывающие металлы переменной валентности (церулоплазмин, мочевая кислота, трансферрин). Тем самым они препятствуют вовлечению их в реакции разложения перекисей, поскольку в присутствии металлов переменной валентности образование высокореакционных радикалов усиливается (Эристер, 1987).
Таким образом, развитие и функционирование клеток в кислородсодержащей среде не представляется возможным без существования защитных систем – специализированных ферментативных и неферментативных антиоксидантов. В живых организмах постоянен процесс образования прооксидантов, уравновешиваемый дезактивацией их антиоксидантными системами. Для поддержания гомеостаза регенерация антиоксидантов должна быть непрерывной. Отсутствие или нарушение в её непрерывной работе приводит к развитию окислительных процессов, к накоплению окислительных повреждений, что сопровождает ряд патологических физиологических процессов, например, старение (Оксенгендлер, 1985).
1.2. Аскорбат как компонент АОС эритроцитов
1.2.1. Строение и физико-химические свойства аскорбата
Витамин С (L-аскорбиновая кислота) входит в состав алифатического ряда витаминов. По своему строению он может быть отнесен к производным углеводов. Это γ-лактон 2,3-дегидро-L-гулоновой кислоты, производное ненасыщенных полиокси-γ-лактонов. Структура близка структуре a-глюкозы.
Благодаря наличию двух асимметричных атомов углерода в 4 и 5 положениях, аскорбиновая кислота (АК) образует 4 оптических изомера и 2 рацемата. D- и L- аскорбиновые кислоты в природе не встречаются и синтезированы искусственным путём.
Наличие в АК двух сопряжённых двойных связей (углерод-углеродной и углерод-кислородной) обуславливает ее способность к обратимому окислению, продуктом которого является дегидроаскорбиновая кислота (ДАК). ДАК устойчива, но ее лактонное кольцо, в отличие от стабилизированного двойной связью лактонного кольца L-АК в водном растворе легко гидролизуется с образованием 2,3-дикетогулоновой кислоты (2,3-ДКГК). Эта реакция необратима, ее скорость возрастает при повышении температуры и рН среды. Через ряд дальнейших превращений ДКГК переходит в щавелевую и L-треоновую кислоты. Такое же превраще
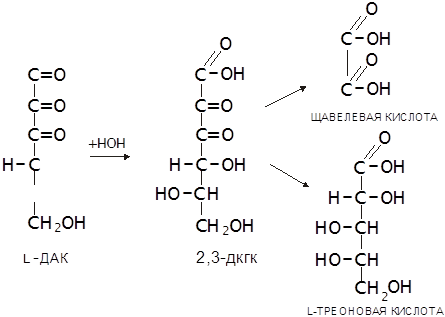 |
ние имеет место в организме (Халмурадов, Тоцкий, 1993):
Способность к О-В превращениям, связанная с ендольной группировкой, которая стабилизирована находящейся в цикле соседней карбонильной группировкой, сопровождающаяся перенесением атомов водорода к акцепторам, является важнейшей каталитической функцией АК в живом организме. L-АК по своей биологической активности высокоспецифична. Витаминная активность проявляется только при наличии свободных гидроксильных групп. Различные функциональные производные по ним лишают молекулу витаминной активности почти полностью, как и гидрирование ненасыщенной связи лактонного кольца. Поэтому L-ДАК имеет витаминную активность, равноценную L-АК, тогда как 2,3-ДКГК полностью ее лишена. Вследствие легкой окисляемости L-АК – донор Н+, она количественно легко восстанавливает многочисленные соединения, как-то: йод, перманганат калия и другие. L-АК – переносчик Н+ в некоторых ферментативных реакциях живой клетки, она легко окисляется пероксидазой, цитохромоксидазой, каталазой. L-АК восстанавливает окисленные формы ферментов, окисляясь в ДАК, обратимо легко регенерирующуюся в АК под действием глутатиона за счет его сульфгидрильной группы:
![]()
![]()
![]()
![]()
Окисление АК катализируется медью, в меньшей степени – катионами серебра и железа. Имеется предположение, что специфическим катализатором окисления АК в животных организмах является белок, синтезирующийся в печени, осуществляющий транспорт меди, обладающий оксигеназной активностью, - церулоплазмин. В меньшей степени окисление аскорбата катализируют другие катионы, в частности, серебра и железа. Комплексоны, флавоноиды тормозят окислительный распад АК. Некоторые белки ингибируют окисление АК, связываясь с ней или путём образования комплекса с медью – сывороточные глобулины (Борец, 1980). Окисление тормозится –SH содержащими соединениями: сернистая кислота блокирует фермент аскорбиназу; С-SH связывает ионы Cu+, удаляя т. с. катализатор окисления АК из реакции (Киверин, 1971).
1.2.2. Биосинтез АК в живом организме
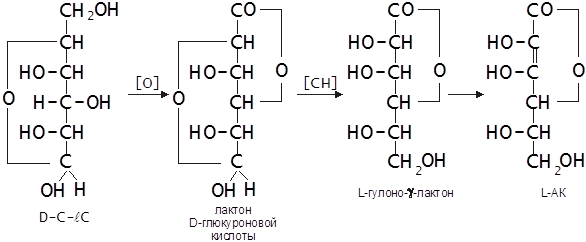 |
L-АК синтезируется в растениях и организме некоторых животных из D-глюкозы через лактон D-глюкуроновой кислоты и L-гулоно-γ-лактон или их производное. В процессе биосинтеза происходит превращение соединений D-ряда в соединения L-ряда (Березовский, 1993):
Биосинтез АК в организме животных происходит в клетках печени, почек, надпочечников, гипофиза, стенки тонкого кишечника (Киварин, 1973).


