 Реферат: Атмосфера
Реферат: Атмосфера
Атмосфера определяет световой и регулирует тепловой режимы Земли. Способствует перераспределению тепла на земном шаре. Лучистая энергия Солнца – практически единственный источник тепла для поверхности Земли – частично поглащается атмосферой. Достигшая поверхности Земли энергия частично поглащается почвой и водоемами. Морями и океанами, частично отражается в атмосферу.
Газовая оболчка предохраняет Землю от чрезмерного остывания и нагревания. Блогадаря ей на Земле не бывает резких перепадов от морозов к жаре и обратно. Ечли бы Земля не была окружена воздушной оболочкой, то в течение одних суток амплитуда колебания температуры достигла бы 2000С: днем стояла бы сильная жара (выше 1000С), а ночью морозо(-1000С). Еще большая разница была бы между зимними и летними температурами.
Великое значение атмосферы и в распределение света. Воздух атмосферы разбивает солнечные лучи на миллион мелких лучей, рассеивает их и создает то равномерное освещение. Наличие воздушной оболочки придает нашему небу голубой цвет, так как молекулы основных элементов воздуха и различные примеси, содержащиеся в нем, рассеивают главным образом лучи с короткой длиной волны, т.е. фиолетовые, синие и голубые.
Атмосфера является проводником звуков. Без нее на Земле цариоа бы тишина, невозможна была бы человеческая речь.
Следствием роста антропогенного выброса парниковых газов и, в первую очередь двуокиси углерода, концентрация которого в настоящее время увеличилась в атмосфере на 25% по сравнению с доиндустриальной эпохой, будет удвоение его содержания к 2050-2070 гг. Это произойдет, если не будет принято каких либо мер по сокращению промышленной эмиссии. Усиление парникового эффекта обусловлено в настоящее время накоплением в атмосфере ряда парниковых газов, вклады которых составляют: двуокись углерода – 61%, метан – 23%, хлорфторуглероды – 12%, закись азота – 4%.
Кислотные дожди!
Кислотные осадки являются проблемой, которая в случае ее бесконтрольного развития, может вызвать в результате существенные экономические и социальные издержки. Окисление почв и вод – это комплекс причин, исходных условий и следующих один за другим процессов в химической и биологической системах, которые мы обобщенно называем нашей окружающей средой. Часть процессов окисления является природной, но данные изменения кислотности в системах почвы и воды ни по скорости, ни по общему охвату не могут быть сравнены с окислением, ставшим результатом собственной деятельности человека в промышленной и энергетической областях,а также в определенной части современного использования земли.
Само понятие “кислотный дождь” вошло в обращение 110 лет тому назад. Английский химик Роберт Ангес Смит обнаружил, что в промышленном городе Манчестере и вокруг него имеются “три вида воздуха”, а именно: воздух с карбонатом аммония в отдаленных полях; воздух с сульфатом аммония в окресностях и воздух с серной кислотой или бисульфатом в городе. В 1872 году он писал о “кислотном дожде” в книге “Воздух и дождь” –начала химической климатологии” и рассматривал в ней ряд тех явлений, о которых мы сейчас говорим в связи с проблемой окисления :сжигание угля, разложение органических материалов, траектория ветров, близость к морю, количество осадков на месте. Смит указывал, что кислый воздух в городе обеспечивает краски в тканях и разъедает поверхности металлов, что кислая дождевая вода повреждает растительность и материалы, что такие вещества, как мышьяк, медь и прочие металлы выпадают вместе с дождями в промышленных районах.
Механизм образования кислотных осадков
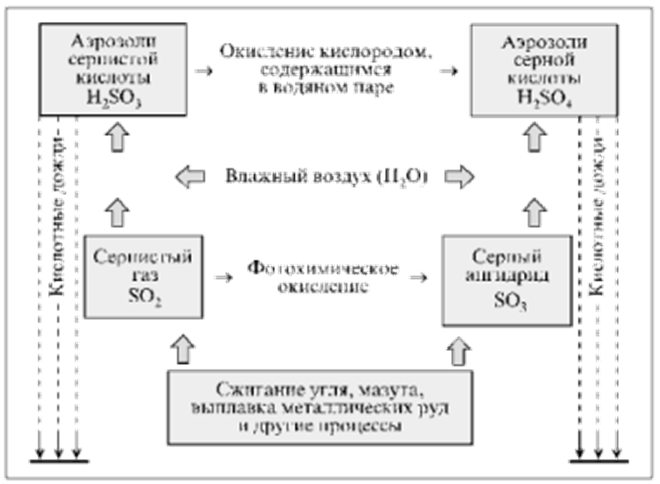
Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот.
Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный ангидрид) SО3:
2SO2 + O2 ® 2SO3,
который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты:
SO3 + Н2O ® Н2SO4.
Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SО2•nH2O, который часто называют сернистой кислотой и изображают условной формулой Н2SО3:
SO2 + H2O ® H2SO3.
Сернистая кислота во влажном воздухе постепенно окисляется до серной:
2Н2SО3 + О2 ® 2Н2SO4.
Аэрозоли серной и сернистой кислот приводят к конденсации водяного пара атмосферы и становятся причиной кислотных осадков (дожди, туманы, снег).
При сжигании топлива образуются твердые микрочастицы сульфатов металлов (в основном при сжигании угля), легко растворимые в воде, которые осаждаются на почву и растения, делая кислотными росы.
Аэрозоли серной и сернистой кислот составляют около 2/3 кислотных осадков, остальное приходится на долю аэрозолей азотной и азотистой кислот, образующихся при взаимодействии диоксида азота с водяным паром атмосферы:
2NО2 + Н2О ® НNО3 + НNО2.
Существуют еще два вида кислотных дождей, которые пока не отслеживаются мониторингом атмосферы. Находящийся в атмосфере хлор (выбросы химических предприятий; сжигание отходов; фотохимическое разложение фреонов, приводящее к образованию радикалов хлора) при соединении с метаном (источники поступления метана в атмосферу: антропогенный – рисовые поля, а также результат таяния гидрата метана в вечной мерзлоте вследствие потепления климата) образует хлороводород, хорошо растворяющийся в воде с образованием аэрозолей соляной кислоты:
Сl• + СН4 ® CН•3 + НСl,
СН•3 + Сl2 ® CН3Cl + Сl•.
Очень опасны выбросы фтороводорода (производство алюминия, стекольное), который хорошо растворяется в воде, что приводит к появлению в атмосфере аэрозолей плавиковой кислоты.
Меры по охране атмосферы от кислотообразующих выбросов
Чистота атмосферного воздуха планеты – одно из приоритетных направлений природоохранной деятельности национальных правительств, которая развивается в рамках программы, принятой на ХIX специальной сессии Генеральной Ассамблеи Организации Объединенных Наций в июне 1997 г.
Международными соглашениями установлены критические нормы выбросов диоксида серы и оксидов азота, ниже которых их воздействие на наиболее чувствительные компоненты экосистем не обнаруживается, а также ряд рекомендаций по осуществлению снижения этих выбросов.
Основными на сегодняшний день методами снижения загрязнения атмосферы, в том числе кислотообразующими выбросами, являются разработка и внедрение различных очистных сооружений и правовая защита атмосферы.
Ведутся исследования по снижению загрязнений от выхлопных газов автомобилей. Наибольшие трудности здесь вызывает именно уменьшение выбросов оксидов азота, которые помимо образования кислотных осадков ответственны за появление фотохимических загрязнителей (фотохимический смог) и разрушение озонового слоя в стратосфере. Для решения этой проблемы ведутся работы по созданию различных каталитических конвертеров, преобразующих оксиды азота в молекулярный азот.
Среди эффективных методов борьбы с выбросами окисленной серы в атмосферу через дымовые трубы следует отметить различные газоочистители, такие, как электрические фильтры, вакуумные, воздушные или жидкие фильтры-скрубберы. В последних газообразные продукты сгорания пропускаются через водный раствор извести, в результате образуется нерастворимый сульфат кальция СаSО4. Этот метод позволяет удалить до 95% SО2, но является дорогостоящим (снижение температуры дымовых газов и понижение тяги требует дополнительных затрат энергии на их подогрев; кроме того, возникает проблема утилизации СаSO4) и экономически эффективен лишь при строительстве новых крупных предприятий. Такой же дорогостоящий метод очистки дымовых газов от оксидов азота с помощью изоциановой кислоты НNСО (удаляется до 99% оксидов азота, превращающихся в безвредные азот и воду).
Восстановление нормальной кислотности водоемов возможно за счет известкования, при этом не только уменьшается кислотность воды, но и повышается ее буферная способность, т. е. сопротивляемость по отношению к будущим кислотным осадкам.
Известкование можно применять и для защиты лесов от кислотных дождей, используя распыление с самолетов свежемолотого доломита (СаСО3•MgCO3), который реагирует с кислотами с образованием безвредных веществ:
СаМg(СО3)2 + 2Н2SО3 = СаSО3 + МgSО3 + 2СО2 + 2Н2О,
СаМg(СО3)2 + 4НNО3 = Са(NО3)2 + Мg(NО3)2 + 2СО2 + 2Н2О.
Для защиты памятников культуры и ценных архитектурных сооружений используют покрытия из высокомолекулярных соединений – силиконов или производных эфиров кремниевой кислоты; для защиты металлических изделий – покрытие их лаком, масляной краской или легирование сталей, образующих устойчивую к кислотам оксидную пленку.
Содержание серы в выбросах можно уменьшить, используя низкосернистый уголь, а также путем физической или химической его промывки. Первая позволяет очистить уголь от неорганических примесей серы, таких, как сульфиды металлов. С помощью второй удаляется органическая сера. Отметим, что физические методы очистки малорентабельны, а применение химических методов очистки из-за ряда технических сложностей эффективно лишь на вновь строящихся электростанциях. Для средних и малых предприятий энергетики используется метод сжигания топлива в кипящем слое, при котором удаляется до 95% диоксида серы и от 50 до 75% оксидов азота.


